Сравнение между флок-тампоном ESwab и зондом с пеннополиуретановым аппликатором (тампоном) Transwab® для сохранения жизнеспособных аэробных бактерий и грибов вида Candida со сложными питательными потребностями
28.08.2012

Abed El-Razeq Issa, Musa Y Hindiyeh and Hiyam Marzouqa
Caritas Baby Hospital, Bethlehem, ОКУППИРОВАННЫЕ ПАЛЕСТИНСКИЕ ТЕРРИТОРИИ
Реферат.
Введение: Хорошо известно, что аспираты жидкостей предпочтительнее образцов, полученных при помощи мазка. Однако из-за того, что образцы с помощью мазка получать проще, в микробиологические лаборатории продолжают поступать образцы от больных, полученные с помощью мазков. В последнее время для улучшения сбора образцов и их доставки созданы два модифицированных устройства на основе жидкой среды Эймса. ESwabs (Copan Diagnostics) это транспортная система, состоящая из нейлонового аппликатора (флок-тампон), а ∑-Transwab® (Medical Wire) это аппликатор из мягкого пенного полиуретанового адсорбента.
Методы: Метод CLSI M40-A для количественной оценки элюции с флок-тампонов использовали для сравнения выживания аэробных бактерий и грибов вида Candida со сложными питательными потребностями в этих двух системах при комнатной температуре (КТ) и при 4°C. Оценивали выживание следующих ATCC микроорганизмов: S. pneumoniae (6305), H. influenzae (10211), N. gonorrhoeae (43609), N. meningitidis (13090); S. pyogenes (19615); C. albicans (14053) и C. parapsolosis (22019). Кратко, непосредственно перед исследованием готовили разведение 1:10 стандарта 0,5 МакФарланда для каждого организма, и по 100 мкл разливали по стерильным пробиркам типа Эппендорф для заражения тампонов. Выживание микроорганизмов определяли через 0, 6, 24, и 48 часов после инкубации при 35°C 5% в SB A или шоколадном агаре. Для того чтобы удовлетворить критериям Института клинических и лабораторных стандартов (CLSI) снижение количества КОЕ не должно составлять более 3 log10.
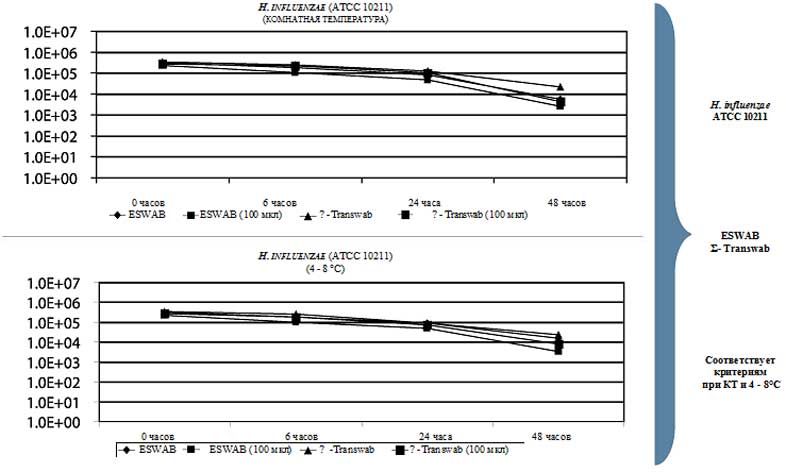
Результаты: С механической точки зрения явное преимущество было за ESwab, так как он полностью впитывал вносимый инокулят, тогда как адсорбция инокулята с помощью ∑-Transwab® была менее эффективной, в среднем, составляя 50 мкл. Оба аппликатора ESwabs и X-Transwab® удовлетворяли критериям CLSI для сохранения жизнеспособности: S. pneumoniae, S. pyogenes, и H. influenzae в течение 48 часов при КТ и при 4°C. Только ESwab сохраняли жизнеспособность N. gonorrhoeae и N. meningitidis в течение 24 и 48 часов, соответственно при КТ и 4°C. ∑-Transwab® сохранял жизнеспособность обоих видов Neisseria только при 4°C. Оба тампона-аппликатора сохраняли жизнеспособность C. albicans и C. parapsolosis при КТ и при 4°C в течение 48 часов.
Заключение: Универсальная система для сбора и транспортировки образцов на основе жидкой среды позволяет проводить несколько испытаний одного образца. По всей видимости, ESwab превосходит аппликатор с полиуретановой пеной в отношении сбора образца. К тому же ESwab удовлетворял критериям приемлемости CLSI для всех исследованных микроорганизмов, тогда как ∑-Transwab® не сохранял жизнеспособность обоих видов Neisseria исследованных при КТ .
Введение.
Диагноз бактериальной инфекции, основанный на получении образцов от больных, в значительной степени, зависит от сбора и транспортировки образцов в лабораторию. Невозможность получения соответствующего образца от больного может привести к неправильному диагнозу и несоответствующему лечению. Хорошо известно, что экссудаты из потенциально инфицированных мест и аспираты жидкостей предпочтительнее образцов, полученных при помощи мазка (1, 2). Однако из-за практической целесообразности использования мазков для получения образцов, в микробиологические лаборатории продолжают поступать клинические образцы, полученные с помощью мазков. Дакроновые или вискозные нити широко используются для производства головки тампона. Эти волокна подвергаются интенсивной обработке для того, чтобы они эффективно собирали и высвобождали образцы от больных, а также сохраняли жизнеспособность микроорганизмов. Широко изучали аппликаторы в сочетании с полужидким агаром Эймса. В последнее время компания Copan Diagnostics внедрила новую систему для транспортировки, состоящую из флок-тампона с модифицированной средой Эймса (1 мл), предназначенную для оптимизации сбора образца и минимального задерживания образца. При изготовлении ESwab использована эксклюзивная технология получения нейлоновых волокон распылением (3, 4). Перпендикулярные волокна нейлона действуют как мягкая щеточка, позволяя улучшить сбор и выделение образца больного. В этом испытании метод CLSI M40-A для количественной оценки элюции с флок-тампонов использовали для сравнения выживания аэробных бактерий и грибов вида Candida со сложными питательными потребностями в двух модифицированных системах для сбора образцов с жидкой средой Эймса, ESwabs (производства Copan Diagnostics) – нейлоновый тампон для транспортировки образцов и ∑-Transwab® (производства Medical Wire) - полиуретановый аппликатор, при комнатной температуре (КТ) и при 4°C.
Материалы и методы.
S. pneumoniae (ATCC 6305), H. influenzae (ATCC 10211), N gonorrhoeae (ATCC 43609), N meningitidis (ATCC 13090); S. pyogenes (ATCC 19615); C. albicans (ATCC 14053) и C. parapsolosis (ATCC 22019).
Система транспортировки тампонов:
ESwabs (Copan Diagnostics): транспортная система, состоящая из нейлонового зонда-тампона (флок-тампон). ∑-Transwab® (Medical Wire & Equipment): аппликатор из мягкого полиуретанового адсорбента.
Чашки с агаром: Чашки с агаром с добавлением 5% крови барана (кат. № Hy-PD 049) и с шоколадным агаром (кат. № PD-013) приобретены в Hy.Labs (Park Tamara, Rehovot, Израиль). Культуры штаммов бактерий: Все штаммы бактерий культивировали на соответствующих средах (агар с 5% крови барана или шоколадный агар) в течение 18 - 24 часов при 37°C. Для приготовления образца использовали хорошо изолированные колонии. Для некоторых микроорганизмов, требовательных к питательным средам, необходимо 48 часов инкубации для приготовления образца.
План испытаний: При оценке разных транспортных систем образца следовали CLSI документу M40-A. Кратко, 0,5 стандарт МакФарланда (1,5 x 108 микроорганизмов/мл) для каждого микроорганизма, выращенного при 37°C в течение 18 - 24 часов, готовили с помощью колориметра BioMerieux Vitek Inc. на 0,85% физиологическом растворе. Готовили разведение 1:10 (1,5 x 107 микроорганизмов/мл) каждого микроорганизма, и 100 мкл (1,5 x 106 микроорганизмов/мл) использовали для заражения каждого тампона (в трех экземплярах). Выживание микроорганизмов при 20 - 25°C определяли через 0, 6, 24 и 48 часов. В каждый период времени жизнеспособные микроорганизмы восстанавливали с аппликаторов в 1 мл физиологического раствора после встряхивания тампонов в течение 30 секунд, и готовили серийные разведения 1:10, 1:100, и 1:1000 на стерильном физиологическом растворе.
Трехкратно образцы по 100 мкл использовали для количественного подсчета микроорганизмов в каждом разведении, заражая 5% SB A или шоколадный агар. Микроорганизмы распределяли по поверхности агара микробиологическим шпателем, и чашки инкубировали при 37°C в 5% C02 инкубаторе.
Анализ результатов: Восстановление бактерий определяли, подсчитывая колонии, полученные в каждом разведении. Количество восстановленных микроорганизмов выражали в среднем показателе, полученном для трех проанализированных образцов, и в проценте от исходного количества (подсчитанного в начале испытания). Для оценки использовали следующие критерии CLSI M40-A: система тампона признана приемлемой для исследованных бактерий, если количество КОЕ, подсчитанное в 0 часов, снизилось не более чем на 3 log 10 при хранении в условиях комнатной температуры, а при хранении при 4°C, не увеличилось более чем на 1 log 10 или снизилось не более чем на 3 log 10, по сравнению с показателем в 0 часов. CLSI установило время анализа хранения 24 часа для N. gonorrhoeae и 48 часов для всех других микроорганизмов.
.jpg)
.jpg)


.jpg)

Выводы.
• ESwabs легко адсорбировали 100 мкл инокулята.
• Адсорбция инокулята с помощью ∑-Transwab была менее эффективной, и в среднем составляла 50 мкл.
• Обе системы на основе жидкой среды Эймса удовлетворяли руководствам CLSI при 4°C для всех исследованных микроорганизмов.
• Только ESwabs удовлетворяли руководствам CLSI для всех микроорганизмов, исследованных при комнатной температуре.
• ∑-Transwab не сохраняли жизнеспособность обоих видов Neisseria species, исследованных в течение 6 часов при комнатной температуре.
• Обе системы поддерживали жизнеспособность обоих исследованных видов Candia.
• Подобные результаты были получены после использования для инокуляции чашек тампонов или аликвот по 100 мкл.
• В общем, ESwabs превосходили по всем параметрам ∑-Transwab для сохранения жизнеспособности аэробных бактерий, требовательных к питательным средам.
Ссылки.
1: Rishmawi N, Ghneim R, Kattan R, Ghneim R, Zoughbi M, Abu-Diab A, Turkuman S.Dauodi R, Shomali I, Issa Ael-R, Siriani I, Marzouka H, Schmid I, Hindiyeh MY. Survival of fastidious and nonfastidious aerobic bacteria in three bacterial transport swab systems. J Clin Microbiol. 2007 Apr;45(4): 1278-83.
2. Hindiyeh M, Acevedo V, Carroll KC. Comparison of three transport systems (Starplex StarSwab II, the new Copan Vi-Pak Amies Agar Gel collection and transport swabs, and ββL Port-A-Cul) for maintenance of anaerobic and fastidious aerobic organisms. J Clin Microbiol. 2001 Jan;39(l):377-80.
3: Nys S, Vijgen S, Magerman K, Cartuyvels R. Comparison of Copan eSwab with the Copan Venturi Transystem for the quantitative survival of Escherichia coli, Streptococcus agalactiae and Candida albicans. Eur J Clin Microbiol Infect Dis. 2010 Apr;29(4):453-6.
4: Van Horn KG, Audette CD, Sebeck D, Tucker KA. Comparison of the Copan ESwab system with two Amies agar swab transport systems for maintenance of microorganism viability. J Clin Microbiol. 2008 May;46(5): 1655-8







