Как жидкостная микробиология может повлиять на организацию рабочего процесса в микробиологической лаборатории

Carla Fontana1,2*, Marco Favaro1, Cartesio Favalli1,2
1Кафедра экспериментальной медицины и хирургии, университет Тор Вергата, Рим, Италия
2Лаборатория клинической микробиологии, поликлиника фонда Тор Вергата, Рим, Италия
Электронная почта: *carla.fontana@uniroma2.it
Жидкостная микробиология (Liquid-based microbiology, LBM) - это будущее технического прогресса развития для микробиологических лабораторий. Так, система Eswab компании Copan упрощает и ускоряет сбор образцов, а также является единственной жидкостной системой, позволяющей выделять все типы бактерий (аэробы, анаэробы, бактерии со сложными питательными потребностями). Кроме того, LBM повышает эффективность выделения микроорганизмов и облегчает получение, транспортировку и хранение образцов. LBM позволяет также широко внедрить в лаборатории автоматизацию, используя либо автоматизированную систему обработки образцов компании Copan (Walk-Away Specimen Processor), либо любую другую имеющуюся на рынке систему обработки образцов, использующую технологии LBM. Данная статья посвящена тому, как LBM может улучшить организацию лабораторного процесса, и описывает опыт нескольких лет нашей работы на основе технологии LBM. Методы LBM позволяют оптимизировать обработку клинических образцов и обладают несколькими важными преимуществами: снижение расходов (вследствие сокращения количества используемых приспособлений), экономия времени врачей и медицинских сестер (меньше времени тратится на выбор устройства для сбора образцов и меньшее количество образцов нужно собирать), экономия времени лабораторного персонала (меньшее количество образцов нужно обрабатывать и анализировать), большее удобство для пациентов (нет необходимости собирать несколько образцов). Единое устройство для сбора образцов, предназначенных для разных исследований, гарантирует также качество исследований, обусловленное однородностью образца и стандартизацией методик.
Ключевые слова: рабочий процесс; жидкостная микробиология; автоматизированная система обработки образцов; молекулярный анализ; рациональное использование лабораторных ресурсов
1. Введение
Автоматизированные системы для сбора образцов, например, система «Walk-Away Specimen Processor» (WASP; компания Copan, Брешия, Италия) и концепция жидкостной микробиологии (LBM) впервые начали внедряться в микробиологических лабораториях с появлением флок-тампонов (FLOQSwabs™ компании Copan). Флок-тампоны, состоящие из многих тысяч перпендикулярно расположенных на кончике аппликатора коротких нейлоновых волокон, собирают материал из большего объема по сравнению с традиционными тампонами (которые представляют собой аппликатор, обернутый волокнистым материалом, который действует как поглощающий слой, задерживающий значительную часть образца внутри слоя волокон). При контакте с поверхностью жидкости волокна флок-тампонов автоматически полностью высвобождают собранный материал. Система ESwab (нейлоновый флок-тампон в пробирке, содержащей 1 мл жидкой транспортной среды Amies) - один из наиболее характерных примеров [1, 2]. Система Eswab и автоматизированная система WASP были представлены компанией Copan Italia в 2005 г. и 2008 г. соответственно. С момента разработки системы ESwab было создано множество других систем и приспособлений. На сегодняшний день не существует клинических образцов, предназначенных для лабораторной микробиологической диагностики, которые не могут быть обработаны с помощью системы WASP. Всесторонне продемонстрирована более высокая эффективность LBM [3, 4]. Преимуществами LBM в сочетании с WASP являются стандартизация процессов посева и поддержание жизнеспособности микроорганизмов, включая те виды, которые особенно трудно культивировать [1-5]. Однако во времена сокращения финансирования лабораторий и в условиях, когда многие лаборатории испытывают нехватку опытных специалистов-микробиологов и лаборантов, возник значительный интерес к автоматизации, которая может сократить затраты рабочего времени на обработку образцов [5]. В нашей лаборатории система, основанная на LBM, была внедрена в 2008 г., и мы использовали ее в целом ряде тестов, включая окрашивание по Граму, посев и молекулярные исследования. Такое широкое применение системы, основанной на LBM, позволяет нам сократить и рационализировать использование различного оборудования и приспособлений (например, для выращивания микроорганизмов, различных приборов и приспособлений для молекулярно-биологических анализов). Мы используем «один тампон для всего», т. е. для большинства микробиологических исследований. После взятия образца и его доставки в лабораторию устройство, основанное на принципе LBM, обрабатывается в лаборатории системой WASP, откуда начинаются специализированные исследованиях в различных отделах лаборатории. В данной статье мы излагаем наш четырехлетний опыт использования методов LBM и автоматической системы для обработки образцов, чтобы показать, как радикально и в лучшую сторону это меняет сам рабочий процесс в лаборатории.
2. Материалы и методы
В данном исследовании мы использовали следующие продукты компании Copan (Брешия, Италия): системы для сбора образцов ESwab, Fecal-swab, SL-solution, LIM broth и BHI broth. Система ESwab используется для микробиологических образцов, которые обычно собираются посредством мазка (мазки из половых органов, носовой полости, ротоглотки, конъюнктивы, уха, ран) и используются для стандартного культивирования (автоматический посев с использованием системы WASP), приготовления мазка, окрашенного по Граму, прямого выявления бактериальных антигенов и токсинов, и молекулярных исследований. Fecal-swab (FS) - система для сбора, транспортировки и хранения образцов кала. В системе FS используется модифицированная жидкая среда Кэри-Блэра, специально предназначенная для поддержания жизнеспособности энтеробактерий. SL-solution - готовая к использованию система разжижения образцов мокроты (содержит дитиотрейтол в качестве активного компонента). SL-solution используется для предварительной обработки образцов из дыхательных путей, содержащих большое количество слизи, предназначенных для окраски по Граму, культивирования и молекулярных исследований. Система LIM broth (пробирка, содержащая 2 мл жидкой среды LIM и стандартный флок-тампон для сбора, транспортировки и обогащения ректовагинальных образцов) использовалась для выявления стрептококков группы В. Жидкая среда LIM является модификацией бульона Тодда-Гевитта, где наличие антибиотиков подавляет рост нормальной бактериальной флоры и гарантирует выделение и поддержание в жизнеспособном виде стрептококков группы В. Наконец, BHI broth (система, содержащая 2 мл жидкой среды BHI, идеально подходящей для поддержания жизнеспособности микроорганизмов) использовалась для хранения образцов, полученных из дыхательных путей, и штаммов Streptococcus pneumonia до посева и проведения молекулярных исследований.
2.1. Обработка образцов из мочеполовых путей
Пробирки E-swab обрабатывались системой WASP (стандартное культивирование и приготовление окрашенных по Граму препаратов для микроскопических исследований - для культивирования было достаточно примерно 50 мкл, а для приготовления мазка, окрашенного по Граму - 30 мкл; см. следующий раздел). Для стандартного культивирования выполнялся четырехсекторный посев штрихом при помощи системы WASP по крайней мере на пять различных сред: колумбийский агар с колистином и налидиксовой кислотой (в аэробных и анаэробных условиях), шоколадный агар с добавкой Isovitalex (в микроаэробных условиях), агар Мак-Конки, агар Сабуро с глюкозой (компания bioMérieux, Marcy l’Etoile, France). После обработки системой WASP пробирки передавались в лабораторию молекулярной биологии для молекулярных исследований.
Молекулярные исследования для образцов, взятых из мочеполовых путей
Образцы в среде Amies (является частью системы Eswab) использовались для выявления патогенов посредством следующих ПЦР-исследований: на Chlamydia trachomatis и Neisseria gonorrhoeae в системе BD ProbeTec™ ET; на бактерии и простейшие, вызывающие вагиноз (Gardnerella vaginalis и Trichomonas vaginalis) с помощью набора Affirm™ VPIII (Becton Dickinson, Нью-Джерси, США); на Mycoplasma genitalium и Ureaplasma urealyticum в системе Duplica real-time PCR (EuroClone, Перо, Италия).
В январе 2013 г. для некоторых из наших молекулярных исследований стала использоваться вновь появившаяся система: Anyplex™ II STI-7 Detection (V1.1) (Seegene Inc., Сеул, Корея), которая базируется на системе для ПЦР в режиме реального времени CFX96™ (Bio-Rad). Система выявляет одновременно C. trachomatis, N. gonorrhoeae, M. genitalium, M. hominis, U. urealyticum, U. parvum и T. vaginalis в образцах мочи, мазках из уретры, влагалища и с шейки матки. Для выявления G. vaginalis использовалась система количественного определения в реальном времени G. vaginalis/Lactobacillus spp. (Sacace). Эта система также базируется на системе для ПЦР в режиме реального времени CFX96™ от компании Bio-Rad.
Для выявления C. trachomatis и N. gonorrhoeae 10 мкл среды Amies из пробирки Eswab охлаждали в среде для разведения образцов (Becton Dickinson) и затем обрабатывали согласно рекомендациям производителя. Для выявления G. vaginalis и T. vaginalis 100 мкл среды Amies из пробирки Eswab непосредственно смешивали с реагентами системы Affirm™ VPIII согласно инструкциям производителя. Для исследования на M. genitalium и U. urealyticum в системе Duplica для ПЦР в режиме реального времени брали 100 мкл среды Amies в соответствии с инструкциями производителя. Для новой системы Anyplex STI-7 и для системы количественного определения в реальном времени G. vaginalis/Lactobacillus spp. 190 мкл среды Amies добавляли к 10 мкл внутреннего контроля из набора и далее действовали согласно инструкциям производителя.
2.2. Обработка образцов из дыхательных путей
Образцы из дыхательных путей [бронхоальвеолярный лаваж (БАЛ), аспират из бронхов (АБ) и мокрота] составляют значительную часть стандартных микробиологических образцов и играют очень важную роль при ведении тяжелых больных. Компания Copan разработала систему SL-Solution - готовую к использованию разжижающую слизь систему в пробирках с аликвотами объемом 1,0 мл. Микроскопическое исследование проводилось после центрифугирования (4000 × g в течение 20 мин). Для приготовления препаратов брали приблизительно 30 мкл осадка, высушивали на воздухе, фиксировали при 42°C и окрашивали PREVI COLOR V1 как описано выше. Валидацию проводили по схеме Мюррея-Вашингтона. Микробное число (выражалось в КОЕ/мл) определяли с помощью системы HB&L (Alifax, Падуя, Италия), учитывая степень разведения вследствие использования системы SL-Solution [6]. Пробирку SL передавали в систему WASP для посева на ряд ростовых селективных сред и селективных сред для отбора (колумбийский агар с колистином и налидиксовой кислотой, шоколадный агар, агар Мак-Конки, агар Сабуро и агар Шедлера), после чего инкубировали при температуре 37°C в аэробных, микроаэробных и анаэробных условиях и вели наблюдение в течение пяти дней.
Молекулярные исследования для образцов, взятых из дыхательных путей
По 1 мл БАЛ, АБ и мокроты вносили в пробирку SL, так чтобы соотношение образец/среда SL составило 1:1 (за исключением образцов, предназначенных для анализатора GeneXpert, для которого производитель рекомендует соотношение 2:1). Образцы перемешивались на вортексе и сразу же анализировались. Мазки образцов, обработанных средой SL, готовились сразу же. Из всех образцов извлекалась ДНК (500 мкл смеси SL/образец) с использованием станции для автоматического выделения нуклеиновых кислот EZ1 Robot (Qiagen Inc.). Полученная ДНК исследовалась на наличие патогенов, перечисленных ниже [7].
ДНК, выделенная из смеси образец/раствор SL, использовалась для выявления патогенов, вызывающих респираторные инфекции. Определение Chlamidophila pneumoniae, Mycoplasma pneumoniae и Legionella pneumophila проводилось посредством системы Duplicate real-time (EuroClone S.p.A., Перо, Италия) на автоматическом анализаторе Smart Cycler. Комплекс Mycobacterium tuberculosis определяли посредством диагностической системы Xpert® MTB/RIF, а отличные от M. tuberculosis микобактерии - посредством системы Genotype Mycobacteria Direct (Hain Lifescience GmbH, Нерен, Германия).
Недавно мы внедрили также новые системы детекции. Система Anyplex™ II RB5 (Seegene) способна выявлять C. pneumoniae, M. pneumoniae, L. pneumophila, Bordetella pertussis и Bordetella parapertussis одновременно. Система Anyplex™ MTB/NTM - многоканальная система для проведения ПЦР в режиме реального времени для выявления M. tuberculosis и отличных от возбудителя туберкулеза микобактерий и для оценки устойчивости к изониазиду/рифампицину в случае положительных результатов исследования на M. tuberculosis. В обеих системах в начале используется обработка образца раствором SL с последующим проведением ПЦР в режиме реального времени на анализаторе CFX96™ (Bio-Rad) в соответствии с инструкциями производителя.
2.3.Обработка образцов, взятых из ран
Среду Amies (500 мкл) из системы Eswab, с помощью которой брали образцы из инфицированных ран (язвы у больных сахарным диабетом или хирургическая инфекция), предварительно обогащали во флаконах HB&L (Alifax) [6, 8]. В системе HB&L™ используются флаконы с желтыми крышками для культивирования и флаконы с синими крышками для теста на остаточную антимикробную активность (тест на остаточную антимикробную активность в рамках данного исследования не проводился). Среда в обоих типах флаконов поддерживает рост широкого спектра микроорганизмов. Поскольку многие микроорганизмы трудно культивировать, в среду добавлено 200 мкл среды для культивирования «трудных микроорганизмов» DEB (Alifax), содержащей НАД, фактор X и гемин. После 6 ч предварительного обогащения смеси образцов со средой для обогащения переносили в стерильные пробирки для автоматической системы (стерильные пробирки с красными крышками, Copan) и высевали с помощью системы WASP (пятисекторный посев штрихом) на следующие среды: колумбийский агар с колистином и налидиксовой кислотой, агар Мак-Конки или агар Сабуро, инкубировали при 37°C и наблюдали в течение пяти дней. Для микроскопического исследования 30 мкл среды Amies с образцом наносили на предметное стекло, фиксировали и окрашивали как описано выше. Препараты оценивали по методу «Q score», разработанному и описанному у Matkosky at al. [9].
Образцы, взятые из ран, и молекулярные исследования
Среда из образца, предварительно обогащенного во флаконах HB&L (200 мкл), ранее засеянных средой Amies из системы ESwab после взятия образцов из ран, использовалась как источник ДНК, которую экстрагировали посредством системы EZ1 (Qiagen Inc., Валенсия, Калифорния, США); 1 мкл полученного элюата использовали в реакции амплификации гена, кодирующего 16S рДНК (праймеры 8F и 516R). По 3 мкл продуктов амплификации брали для секвенирования посредством набора BigDye Terminator v1.1 Cycle Sequencing-ready reaction kit (ABI PRISM) (Applera, Фостер-сити, Калифорния, США). Электрофорез и генетический анализ проводили на анализаторе ABI 310 (Applera); смешанные образцы анализировались посредством прямого секвенирования с использованием системы Mixed RipSeq (Isentio, Берген, Норвегия) [10].
2.4.Обработка образцов кала, ректальных мазков и мазков из промежности
Образцы кала (4-5 мг) брали с помощью системы FS в палате и доставляли в лабораторию. Система FS предназначена для сбора образцов из ЖКТ (образцы кала, ректальные мазки и мазки из промежности). Система состоит из ректального тампона и флакона, содержащего 2 мл жидкой транспортной среды Кэри-Блэра, специально разработанной для сбора, транспортировки и поддержания жизнеспособности кишечной микрофлоры и для поддержания стабильности нуклеиновых кислот в ходе транспортировки образца при комнатной температуре.
Наиболее востребованным исследованием был посев на Salmonella, Shigella и Campylobacter spp. После поступления в лабораторию пробирку FS кратковременно встряхивали на вортексе, 500 мкл каждого образца инокулировали в пробирку компании Copan для автоматических систем с 2 мл селенитового бульона и инкубировали в течение 6 ч при 37°C. После этого образцы высевали на различные чашки с селективным агаром посредством системы WASP. Для выявления отдельных патогенов, например, Campylobacter spp., энтерогеморрагических и энтеропатогенных штаммов Escherichia coli (EHEC и EPEC соответственно), 100 мкл среды Кэри-Блэра прямо использовали в микроиммунохроматографической системе, такой как ImmunoCard STAT!® CAMPY или ImmunoCard STAT!® EHEC (Meridian Bioscience, Inc.; Цинциннати, Огайо, США). В случае выявления Campylobacter spp. 30 мкл среды Кэри-Блэра высевали на селективный агар Campylosel (bioMerieux) посредством системы WASP, инкубировали 37°C в микроаэробных условиях и наблюдали в течение 72 ч для определения чувствительности изолятов к антибиотикам. В случае выявления EHEC и EPEC 30 мкл среды Кэри-Блэра из пробирки FS высевали на селективный агар O157 (bioMerieux). Для выявления Yersinia spp. 30 мкл среды Кэри-Блэра из пробирки FS напрямую высевали на чашку с CIN агаром для выделения иерсиний (bioMerieux), инкубировали при 37°C в аэробных условиях и наблюдали в течение 48 ч. При выявлении всех этих патогенов посев проводился при помощи системы WASP.
Токсины Clostridium difficile выявляли с помощью системы Xpert™ для C. difficile (Cepheid Europe, Франция): 150 мкл среды Кэри-Блэра из пробирки FS добавляли к реагенту для системы и далее следовали инструкциям производителя. Для культивирования возбудителя 30 мкл среды Кэри-Блэра напрямую высевали на чашки ChromID™ для выявления C. difficile (bioMerieux) и инкубировали в анаэробных условиях, пока колонии на чашках не вырастали в достаточной степени для исследования чувствительности возбудителя к антибиотикам.
Для ректальных мазков и мазков из промежности образцы собирали с помощью системы Eswab. Среду Amies (500 мкл) из пробирки Eswab переносили в пробирку с селенитовым бульоном (Copan). После 6 ч селективного обогащения пробирки сразу же помещали в систему WASP для посева на селективный агар, описанный выше (посев на Salmonella, Shigella и Campylobacter spp. материала из образцов кала). После этого 30 мкл селенитового бульона высевали на чашки посредством пятисекторного посева штрихом.
2.5. Обработка ректовагинальных образцов для анализа на стрептококки группы В
Система LIM broth использовалась для получения ректовагинальных образцов (исследование на стрептококки группы В). Образцы инкубировались в течение 16-24 ч при 37°C; после селективного обогащения 30 мкл среды LIM рассевали на поверхности агара Brilliance GBS (Oxoid) посредством системы WASP, инкубировали при 37°C в аэробных условиях и наблюдали в течение 24 и 48 ч [11-13].
2.6.Другие образцы
Недавно мы стали использовать мазки из промежности для скрининга в нашей больнице на носительство в ЖКТ полирезистентных штаммов Acinetobacter baumannii и устойчивых к карбапенемам энтеробактерий. В обоих случаях для сбора образцов используется система Eswab. Среду Amies (30 мкл) рассевали штрихом на хромогенные среды (CHROMAGAR ACINETOBACTER (Pbi international; Милан, Италия) и агар Brilliance CRE (Oxoid Ltd; Кембридж, Великобритания)) посредством системы WASP. Затем чашки инкубировали при 37°C в аэробных условиях и наблюдали в течение 48 ч [14,15].
2.7. Система BHI
Это новая разработка компании Copan: пробирки, содержащие 2 мл бульона BHI (бульон с сердечно-мозговым экстрактом). Этот продукт использовался в нашей лаборатории для поддержания жизнеспособности микроорганизмов в образцах, культивирование которых невозможно в момент доставки (например, если образцы поступили в лабораторию ночью) или поддержания жизнеспособности патогенов до проведения некоторых молекулярных исследований (например, молекулярное генотипирование S. pneumoniae (данные не приведены)).
2.8.Окрашивание образцов по Граму
Покровные стекла, приготовленные с 30 мкл среды Amies, высушивали на воздухе или осторожно подогревали до 42°C, а затем окрашивали с помощью автоматической системы для окрашивания по Граму PREVI COLOR V1 (bioMerieux) в соответствии с инструкциями производителя [3].
3. Результаты
Наш опыт широкого применения систем и приборов, основанных на принципе LBM, показывает, что лаборатория, в которой большинство операций выполняется вручную, может автоматизировать ряд операций, перейдя от традиционных систем сбора образцов (включая те, которые предназначены для молекулярных исследований) к методам жидкостной микробиологии (Рисунок 1). Одни и те же образцы, собранные с помощью устройств, основанных на принципах LBM, могут быть использованы для приготовления мазков с целью окрашивания по Граму, для посева, для определения антигенов и токсинов и для самых разных молекулярных исследований. Подобный переход не сказывается на чувствительности определений и значительно повышает качество рабочего процесса, поскольку сокращает время обработки образцов до времени, сходного с временем, необходимым для прямого секвенирования.
В неделю мы исследуем в среднем около 200 урогенитальных образцов. Из них 80% требуют сочетания традиционного посева с молекулярными исследованиями (например, для выявления возбудителей инфекций, передающихся половым путем: C. tracomatis, N. gonorrhoeae, G. vaginalis, T. vaginalis, Mycoplasma spp. и Ureaplasma spp.). Для возбудителей, перечисленных выше, использование системы Eswab не снижало доли образцов, дававших положительный результат, относительно прогноза на основании предшествующих определений, то есть 1,5% для for C. tracomatis, 1,3% для N. gonorrhoeae, 13,78% для G. vaginalis, менее 0,2% для T. vaginalis и приблизительно 10% для Mycoplasma spp. [16]. Посевы также давали отличные результаты, как сообщалось в предшествующих исследованиях [4,5,17,18].
Что касается результатов для образцов из дыхательных путей, на сегодня мы исследовали 7052 образцов (3461 образца БАЛ, 947 образцов АБ и 3713 образцов мокроты), для которых приблизительно в 70% случаев требовалось сочетание традиционного посева с молекулярными исследованиями (на Mycobacterium tubercolosis, на микобактерии, отличные от возбудителя туберкулеза, а также определение Chlamidophila pneumoniae, Mycoplasma pneumoniae и Legionella pneumophila). Раствор SL прекрасно подходит для выделения микроорганизмов при посеве с помощью системы WASP и не мешает проведению молекулярных исследований. Им удобно пользоваться, и он обеспечивает быстрое и полное разжижение образца без предварительной инкубации. Единственный недостаток системы касается микроскопических исследований (особенно окрашивания по Граму); чтобы сохранить целостность клеточных структур и морфологических деталей, мазок должен готовиться сразу же после разжижения образцов в растворе SL. Значимого ингибирования реакций амплификации в различных молекулярных исследованиях не выявлено. Собственно, анализировать повторно требовалось только 10% обработанных образцов, причем большинство из них были образцами мокроты, с которыми особенно трудно работать из-за особенно большого количества слизи.
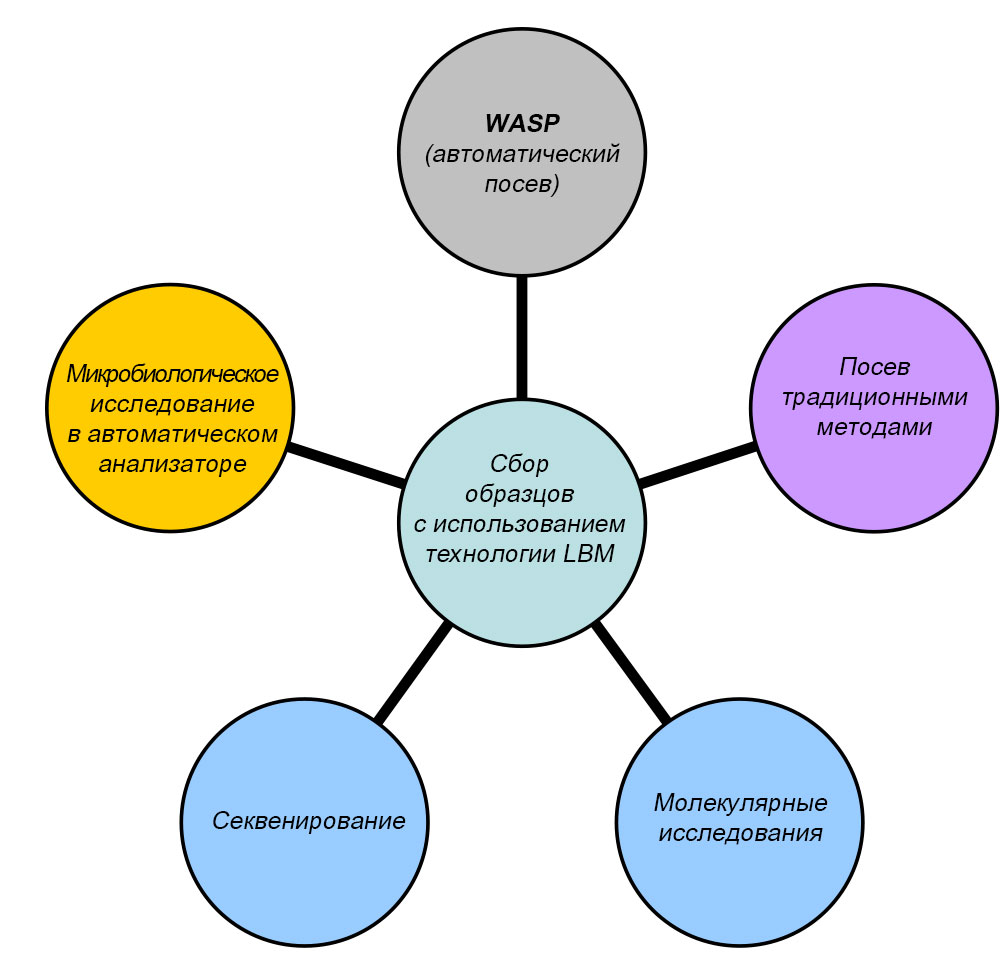
Рисунок 1. Ведущая роль устройств, использующих методы LBM, в многоотраслевой, выполняющей различные исследования лаборатории.
Весьма интересные результаты были получены при сравнении прямого секвенирования в системе Mixed RipSeq (Isentio) и посева образцов, взятых из ран. Наши предварительные результаты по 15 мазкам, взятым из ран (из общего количества 5956 мазков из ран, полученных с помощью системы Eswab), показали, что прямое секвенирование смешанных образцов, проводившееся на образцах в среде Amies из системы ESwab после обогащения в среде HB&L, позволяло выявлять ряд патогенов, которые не вырастали при посеве. В частности, в пяти образцах была выявлена смешанная культура возбудителей, включавшая в себя грамотрицательные (P. mirabilis, A. baumannii и B. melitensis), грамположительные (S. aureus) и анаэробные бактерии (Prevotelladisiens spp.),которые не удавалось выделить при стандартном посеве.
Мы обработали свыше 5000 образцов кала, 1500 ректальных мазков и 100 мазков из промежности. Система FS показала свою высокую пригодность для транспортировки и хранения кишечных патогенов. Она использовалась сама по себе, для исследований на антигены и токсины возбудителей, и в сочетании с селективными жидкими средами, особенно с селенитовым бульоном, в системе WASP. В этих условиях выделение и выявление компонентов и продуктов жизнедеятельности бактерий не обладало никакими недостатками. В сравнении с доставкой образцов кала в сухом виде в контейнерах, доля положительных результатов оставалась той же для всех патогенов, за исключением C. difficile и энтерогеморрагических штаммов E. coli. За прошедшее время мы изолировали и выделили энтерогеморрагический штамм E. coli. (O113, положительный результат анализа на ген vtx1; этот штамм был любезно охарактеризован д-ром Caprioli из Национального института здоровья Италии (данные не приведены)). В Германии ВОЗ опубликовала предупреждение, касающееся случаев инфекции энтерогеморрагическими штаммами E. coli. и вызванного ими гемолитико-уремического синдрома (доступно на сайте http://www.who.int/csr/don/2011_06_02/en/index.html). Это был наш первый и единственный случай инфекции энтерогеморрагическими штаммами E. coli. Что касается C. difficile, распространенность этих изолятов после внедрения системы FS (широкое внедрение началось в середине 2010 г.) выросла с 14% (87 положительных на C. difficile образцов кала из 625 образцов, исследовавшихся в 2010 г.) до 19% (115 положительных образцов среди 607 образцов, исследовавшихся в 2011 г.) и затем до 26% (164 положительных образцов среди 633 образцов, исследовавшихся в 2012 г.). Однако высокая распространенность таких изолятов в 2012 г. может быть связана с местной вспышкой распространенности штамма C. difficile NAP 1/027 (43 изолята), чего не отмечалось ранее. Молекулярные исследования образцов кала также дали хорошие результаты, единственным исключением были несколько образцов, в которых токсины C. difficile присутствовали в количествах, близких к порогу определения для системы Xpert™ C. difficile (в частности потому, что они были взяты у больных, которые раньше уже лечились по поводу инфекций, вызванных C. difficile). Поэтому использование для исследований образцов, взятых с помощью системы FS, может вызвать увеличение доли положительных результатов исследований на токсины C. difficile (положительный результат с пограничными значениями может быть на самом деле отрицательным результатом) [19].
Система LIM broth для выявления стрептококков группы В позволяет более эффективно выделять данные патогены, и наши данные подтверждают ранее описанные результаты. Распространенность изолятов, зафиксированная в 2009 г., когда система FS еще не применялась широко, в сравнении фиксируемой сегодня значительно выросла: 2,9% и 7,6%, соответственно [17].
Наконец, результаты обследования на носительство в ЖКТ полирезистентных штаммов Acinetobacter baumannii и устойчивых к карбапенему энтеробактерий также обнадеживают, пусть даже число исследованных образцов слишком мало, чтобы верно оценить распространенность таких изолятов у носителей.
4. Обсуждение
С момента появления системы для сбора образцов ESwab было разработано много других продуктов. Таким образом, на сегодня во всех отраслях деятельности микробиологической лаборатории нет или почти нет клинических образцов, которые нельзя обработать с помощью системы WASP, и работу с которыми не упростило и не усовершенствовало внедрение методов жидкостной микробиологии [1,2,4,11,17,18].
В нашей лаборатории мы внедрили систему LBM в 2008 г. и использовали ее для ряда различных анализов, включая посевы, окрашивание по Граму и многие молекулярные исследования. Автоматическая система обработки образцов WASP улучшила организацию рабочего процесса в лаборатории, позволив перераспределить персонал по специализированным отделениям [20-22]. Группа продуктов компании Copan для жидкостной микробиологии дала нам возможность оптимизировать рабочий процесс, особенно вследствие возможности их применения для самых различных исследований (приготовление мазка, окрашенного по Граму, культивирование микроорганизмов с ручным и автоматизированным засевом, многие молекулярные исследования) [1,3,17,18,22]. Методы жидкостной микробиологии применяются для анализов, требующих выращивания микроорганизмов в культуре, дают возможность оптимизировать работу с клиническими образцами и обладают рядом важных преимуществ: снижение расходов (вследствие сокращения количества используемых приспособлений), экономия времени врачей или медицинских сестер (меньше времени тратится на выбор устройства для сбора образцов и меньшее количество образцов нужно собирать), экономия времени лабораторного персонала (меньшее количество образцов нужно обрабатывать и анализировать), большее удобство для пациентов (нет необходимости собирать несколько образцов). Уникальное устройство для нескольких исследований гарантирует также качество исследований, обусловленное однородностью образца и стандартизацией методик. Наконец, системы для LBM, которые обрабатываются в автоматизированных анализаторах, позволяют добиться большей стандартизации, что важно для сопоставимости образцов и результатов анализов [5,20-22].
Полученные нами результаты демонстрируют ощутимые изменения в организации рабочего процесса и, разумеется, преимущества, связанные с внедрением LBM. Унификация систем для сбора образцов позволяет сократить их обработку вручную и способствует стандартизации методик. Все это - основные изменения, которые микробиологии должны быть готовы принять и внедрить в лаборатории для достижения надлежащей микробиологической практики и во благо пациентов. В ближайшие годы главным для микробиологов должна стать способность не отставать от инноваций и внедрять их в процесс диагностики, приспосабливая к нескольким различным технологиям. Мы полагаем, что наша работа является примером этого процесса изменений.
5. Благодарности
Мы признательны Pelliccioni M., Di Traglia L, Basile E., Magnanti M., Falcione F., Mauti A. за техническое обеспечение нашего исследования.
ЛИТЕРАТУРА
[1] K. G. Van Horn, C. D. Audette, D. Sebeck and K. A. Tucker, “Comparison of the Copan ESwab System with Two Amies Agar Swab Transport Systems for Maintenance of Microorganism Viability,” Journal of Clinical Microbiology, Vol. 46, Suppl. 5, 2008, pp. 1655-1658. http://dx.doi.org/10.1128/JCM.02047-07
[2] K. G. Van Horn, C. D. Audette, K. A. Tucker and D. Sebeck, “Comparison of 3 Swab Transport Systems for Direct Release and Recovery of Aerobic and Anaerobic Bacteria,” Diagnostic Microbiology and Infectious Diseases, Vol. 62, No. 4, 2008, pp. 471-473. http://dx.doi.org/10.1016/rdiagmicrobio.2008.08.004
[3] C. Fontana, M. Favaro, D. Limongi, J. Pivonkova and C. Favalli, “Comparison of the eSwab Collection and Transportation System to an Amies Gel Transystem for Gram Stain of Clinical Specimens,” BMC Research Notes, Vol. 2, No. 1, 2009, p. 244. http://dx.doi.org/10.1186/1756-0500-2-244
[4] G. Jones, R. Matthews, R. Cunningham and P. Jenks, “Comparison of Automated Processing of Flocked Swabs with Manual Processing of Fiber Swabs for Detection of Nasal Carriage of Staphylococcus aureus,” Journal of Clinical Microbiology, Vol. 49, No. 7, 2011, pp. 27172718. http://dx.doi.org/10.1128/JCM.00504-11
[5] P. P. Bourbeau and B. L. Swartz, “First Evaluation of theWASP, a New Automated Microbiology Plating Instrument,” Journal of Clinical Microbiology, Vol. 47, No. 4, 2009, pp. 1101-1106. http://dx.doi.org/10.1128/JCM.01963-08
[6] C. Fontana, M. Favaro, S. Minelli, M. C. Bossa, A. Altieri and C. Favalli, “A Novel Culturing System for Fluid Samples,” Medical Science Monitor, Vol. 15, No. 2, 2009, pp BR55-BR60.
[7] U. Edwards, T. Rogall, H. Blocker M. Emde and E. C. Bottger, “Isolation and Direct Complete Nucleotide Determination of Entire Genes Characterization of a Gene Coding for 16S Ribosomal RNA,” Nucleic Acid Research, Vol. 17, No. 19, 1989, pp. 7843-7853. http://dx.doi.org/10.1093/nar/17.19.7843
[8] M. Schmohl, S. Beckert, T. O. Joos, A. Königsrainer, N. Schneiderhan-Marra and M. W. Löffler, “Superficial Wound Swabbing: A Novel Method of Sampling and Processing Wound Fluid for Subsequent Immunoassay Analysis in Diabetic Foot Ulcerations,” Diabetic Care, Vol. 35, No. 11, 2012, pp. 2113-2120. http://dx.doi.org/10.2337/dc11-2547
[9] C. Matkosky, E. S. Susan and L. K. Deanna, “Evaluation of the Q Score and Q234 System fro Cost Effective and Clinically Relevant Interpretation of Wound Cultures,” Journal of Clinical Microbiology, Vol. 44, No. 5, 2006, pp. 1869-1872.http://dx.doi.org/10.1128/JCM.44.5T869-1872.2006
[10] O. Kommedal, B. Karlsen and O. Saebo, “Analysis of mixed Sequencing Chromatograms and Its Application in Direct 16S rRNA Gene Sequencing of Polymicrobial Samples,” Journal of Clinical Microbiology, Vol. 46, No. 11, 2008, pp. 3766-3771. http://dx.doi.org/10.1128/JCM.00213-08
[11] J. S. Heelan, J. Struminsky, P. Lauro and C. J. Sung, “Evaluation of a New Selective Enrichment Broth for Detection of Group B Streptococci in Pregnant Women,” Journal of Clinical Microbiology, Vol. 43, No. 8, 2005, pp. 896-897.http://dx.doi.org/10.1128/JCM.43.2.896-897.2005
[12] A. Trotman-Grant, T. Raney and J. D. Bard, “Evaluation of Optimal Storage Temperature, Time, and Transport Medium for Detection of Group B Streptococcus in Strep B Carrot Broth,” Journal of Clinical Microbiology, Vol. 50, No. 7, 2012, pp. 2446-2449. http://dx.doi.org/10.1128/JCM.00238-12
[13] B. R. Berg, J. L. Houseman, M. A. Garrasi, D. W. Newton and C. L Young, “Culture-Based Method with Performance Comparable to That of PCR-Based Methods for Detection of Group B Streptococcus in Screening Samples from Pregnant Women,” Journal of Clinical Microbiology, Vol. 51, No. 10, 2013, pp. 1253-1255. http://dx.doi.org/10.1128/JCM.02780-12
[14] A. T. Kerri, W. W. L. Hsiao, A. D. Harris, C. C. Stine, D. A. Rasko and J. K. Johnson, “Patients with Acinetobacterbaumannii Bloodstream Infections Are Colonized in the Gastrointestinal Tract with Identical Strains,” American Journal of Infection Control, Vol. 38, No. 9, 2010, pp. 751-753. http://dx.doi.org/10.1016/j.ajic.2010.03.005
[15] A. Adler, S. Navon-Venezia, J. Moran-Gilad, E. Marcos, D. Schwartz and Y. Carmeli, “Laboratory and Clinical
Evaluation of Screening Agar Plates for Detection of Carbapenem-ResistantEnterobacteriaceaefrom Surveillance RectalSwabs,”Journal of Clinical Microbiology, Vol. 49, No. 6, 2012, pp. 2239-2242. http://dx.doi.org/10.1128/JCM.02566-10
[16] M. C. Salfa, V. Regine, M. Giuliani, M. Ferri, B. Suligoi e la Rete Nazionale dei Laboratori per le Infezioni Sessualmente Trasmesse, “La Sorveglianza delle Infezioni Sessualmente Trasmesse Basata su una rete di Laboratori: 16 Mesi di Attivita,” Notiziario ISS, Vol. 23, No. 10, 2010, pp. 11-15.
[17] N. A. El Aila, I. Tency, G. Claeys, B. Saerens, P. Cools, H. Verstraelen, M. Temmerman, R. Verhelst and M. Vaneechoutte, “Comparison of Different Sampling Techniques and of Different Culture Methods for Detection of Group B Streptococcus Carriage in Pregnant Women,”
BMC Infectious Diseases, Vol. 10, 2010, p. 285. http://dx.doi.org/10.1186/1471-2334-10-285
[18] C. A. Rivers and J. R. Schwebke, “Viability of Trichomonas vaginalis in Copan Universal Transport Medium and eSwab Transport Medium,” Journal of Clinical Mi-
crobiology, Vol. 46, No. 9, 2008, pp. 3134-3135. http://dx.doi.org/10.1128/JCM.00841-08
[19] C. E. Gyorke, S. Wang, J. L. Leslie, S. H. Cohen, J. V. Solnick and C. R. Polage, “Evaluation of Clostridium difficile Fecal Load and Limit of Detection during a Prospective Comparison of Two Molecular Tests, the Illumigene C. difficile and Xpert C. difficile/Epi Tests,” Journal of Clinical Microbiology, Vol. 51, No. 1, 2001, pp. 278-280. http://dx.doi.org/10.1128/JCM.02120-12
[20] P. P. Bourbeau and N. A. Ledeboer, “Automation in Clinical Microbiology” Journal of Clinical Microbiology, Vol. 51, No. 6, 2013, pp. 1658-1665. http://dx.doi.org/10.1128/JCM.00301-13
[21] O. Dumitrescu, O. Dauwalder and G. Lina, “Present and Future Automation in Bacteriology,” Clinical Microbiology and Infection, Vol. 17, No. 5, 2011, pp. 649-650. http://dx.doi.org/10.1111/j.1469-0691.2011.03511.x
[22] G. Greub and G. Prod’hom “Automation in Clinical Bacteriology: What System to Choose?” Clinical Microbiology and Infection, Vol. 17, No. 5, 2011, pp. 655-660. http://dx.doi.org/10.1111/j.1469-0691.2011.03513.x
Список сокращений
АБ - аспират из бронхов
БАЛ - бронхоальвеолярный лаваж
ДНК - дезоксирибонуклеиновая кислота
ЖКТ - желудочно-кишечный тракт
КОЕ - колониеобразующая единица
НАД - никотинамидадениндинуклеотид
ПЦР - полимеразная цепная реакция
EHEC - энтерогеморрагические штаммы E. coli (enterohemorrhagic E. coli)
EPEC - энтеропатогенные штаммы E. coli (enteropathogenic E. coli)
FS - тампон для взятия образцов кала (fecal swab)
LBM - жидкостная микробиология (liquid based microbiology)
WASP - автоматизированная система обработки образцов (walk away specimens processor)







