Консервация морфологии клеток и определение человеческой ДНК с помощью ПЦР в реальном времени в новой среде CyMol и жидкой среде Pap
Santina Castriciano*, Arnalde Giambra
Copan, Brescia, Italy
ВВЕДЕНИЕ
Освещение проблемы: Тесты, основанные на амплификации нуклеиновых кислот (NAAT- nucleic acids amplification tests) широко используются для диагностики инфекционных заболеваний, а цитология до сих пор является наиболее распространённым методом диагностики неинфекционных заболеваний. Система консервации, поддерживающая многочисленные методы диагностики, будет крайне полезна. Целью являлась оценка способности среды Copan CyMol (CM) консервировать и стабилизировать клетки человека и нуклеиновые кислоты в сравнении со средами ThinPrep (TP) (Cytyc) и SurePath (SP) (TriPath) LPap.
Методы: клетки слизистой оболочки ротовой полости (BC – buccal cells), собранные с помощью флок-тампонов, и образцы осадка мочи (UP – urine pellets), полученные от добровольцев, помещали в среды CM, TP и SP. Готовили два комплекта образцов: один для цитологического исследования и второй для теста, основанного на амплификации нуклеиновых кислот, после чего проводили анализ в начальный момент времени и при хранении сроком до 6 недель при комнатной температуре. Приготовление, окраска и анализ цитоспиновых мазков проводились цитологами . Экстракция нуклеиновых кислот проводилась на колонках Quiagen, а стабильность человеческой ДНК была проанализирована с помощью ПЦР в реальном времени. Цервикальные соскобы (CS – cervical swabs) (N=10) были собраны и помещены в PBS, перемешаны на вортексе и их аликвотные объёмы были добавлены в CM и TP; стабильность ДНК была проанализирована на разных сроках хранения.
Результаты: Морфология клеток в образцах BC и UP была похожей в препаратах, приготовленных в средах CM, TP и SP, хранившихся в течение 6 недель. Препараты, приготовленные в среде SP, были окрашены менее интенсивно. Клетки были хорошо сохранены, наблюдалось наличие ядерного хроматина и окрашивания цитоплазмы. Во всех образцах клеток BC и UP, приготовленных в трёх средах, наблюдалось сходное восстановление клеточной ДНК с небольшой потерей после 6 недель. Человеческая ДНК из CS была стабильна до 30 дней в средах CM и TP.
Заключение: Новая среда Copan CyMol сохранила человеческие клетки для морфологических исследований и стабилизировала человеческую ДНК на срок до шести недель для тестирования с помощью ПЦР.
ОСВЕЩЕНИЕ ПРОБЛЕМЫ
• Тесты, основанные на амплификации нуклеиновых кислот (NAAT) широко используются в диагностике инфекционных заболеваний, а цитология до сих пор является наиболее распространённым методом диагностики неинфекционных заболеваний. Система консервации, поддерживающая использование многочисленных диагностических методов, будет крайне полезна.
Целью работы была оценка способности среды Copan CyMol консервировать и стабилизировать человеческие клетки и нуклеиновые кислоты в сравнении со средой ThinPrep (Cytic) и жидкой средой Pap SurePath (TriPath).
МЕТОДЫ
• Клетки слизистой оболочки ротовой полости, собранные с помощью флок-тампонов у здоровых доноров, помещали в пробирки объёмом 2.0 со средами CyMol, ThinPrep и SurePath, которые были внесены в лаборатории.
• От образцов мочи, собранных у здоровых добровольцев, отбирали 10 мл, центрифугировали в течение 5 минут при 1000 об/мин, удаляли супернатант и ресуспендировали клеточный осадок в пробирках объёмом 2.0 мл со средами CyMol, ThinPrep и SurePath.
Для всех трёх сред готовили 2 набора пробирок с клетками слизистой оболочки ротовой полости и клетками осадка мочи. Один набор использовался для цитологических исследований, а второй — для молекулярного анализа.
• Морфологическое и молекулярное тестирование выполнялось в начальный момент времени, через одну, две и шесть недель хранения при комнатной температуре.
Цитологические мазки готовились, окрашивались и исследовались профессиональным цитологом.
Образцы клеток слизистой оболочки ротовой полости и клеток осадка мочи, приготовленные во всех трёх средах, перемешивали вручную в течение 15 секунд, 100 микролитров каждого образца помещали в цитологическую воронку с предметным стеклом и центрифугировали в течение 5 минут при 1500 об/мин.
Цитологические мазки на предметных стёклах удаляли с центрифуги и фиксировали 95% этиловым спиртом в течение 10 минут и окрашивали по модифицированной методике Папаниколау.
Для молекулярного тестирования: нуклеиновые кислоты экстрагировали из 250 микролитров каждого образца клеток слизистой оболочки ротовой полости и клеток осадка мочи, приготовленных в трёх средах, с использованием набора QIAamp MiniElute Media Kit.
Пять микролитров нуклеиновых кислот, выделенных из каждого образца, анализировали методом количечественной ПЦР в реальном времени с использованием праймеров для β-актина на амплификаторе RotorGene, Corbett Research.
10 цервикальных мазков, собранных с помощью нового цервикального флок-тампона, тестировали следующим образом:
После сбора каждый мазок помещали в пробирку с 1 мл фосфат-солевого буфера.
• Каждую пробирку с мазком перемешивали на вортексе и добавляли эквивалентные аликвотные объёмы образца в пробирку, содержащую 2.0 мл среды CyMol и другую пробирку, содержащую 2 мл среды ThinPrep.
Стабильность ДНК в начальной точке и спустя 5 и 30 дней хранения при комнатной температуре анализировали с помощью тех же методов экстракции и амплификации, которые были использованы для образцов клеток слизистой оболочки ротовой полости и клеток осадка мочи.

Флок-тампон, использованный для сбора цервикальных образцов
РЕЗУЛЬТАТЫ
Окрашивание по Папаниколау клеток слизистой оболочки ротовой полости и клеток осадка мочи
.jpg)
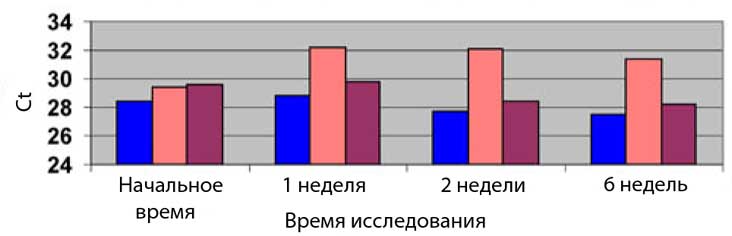
Определение ДНК, выделенной из образцов клеток слизистой оболочки ротовой полости, хранившихся в разных средах в течение различного времени при комнатной температуре

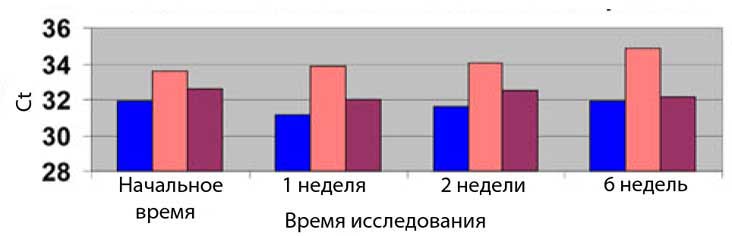
Определение ДНК, выделенной из образцов клеток осадка мочи, хранившихся в разных средах в течение различного времени при комнатной температуре

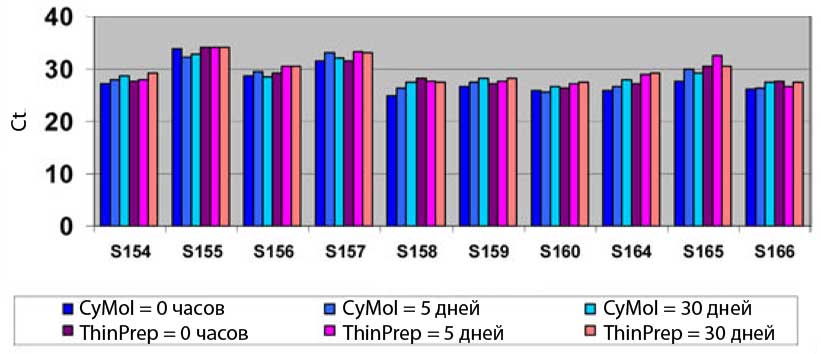
Стабильность ДНК в средах CyMol и ThinPrep, протестированная спустя 0, 5 и 30 дней при комнатной температуре
• Морфология клеток слизистой оболочки ротовой полости и клеток осадка мочи в начальный момент временд и была сходна в препаратах, приготовленных с использованием сред CyMol, ThinPrep и SurePath.
• Клетки слизистой оболочки ротовой полости и клетки осадка мочи в препаратах, приготовленных с использованием сред CyMol и ThinPrep и хранившихся в течение 6 недель, были хорошо сохранены и наблюдалось наличие ядерного хроматина и окрашивания цитоплазмы.
• Клетки слизистой оболочки ротовой полости и клетки осадка мочи в препаратах, приготовленных с использованием среды SurePath, были окрашены менее интенсивно.
• Во всех образцах клеток слизистой оболочки ротовой полости и клеток осадка мочи, приготовленных в трёх средах, наблюдалось схожее восстановление клеточной ДНК с небольшой потерей после 6 недель.
Человеческая ДНК, выделенная из цервикальных образцов, была стабильна до 30 дней в средах CyMol и ThinPrep
ЗАКЛЮЧЕНИЕ
Новая среда Copan CyMol сохранила человеческие клетки для морфологических исследований и стабилизировала человеческую ДНК на срок до шести недель для тестирования с помощью ПЦР.
Среда Copan CyMol может быть использована в приготовлении цитологических препаратов для морфологических исследований клеток на наличие инфекционных и неинфекционных заболеваний.
Среда Copan CyMol стабилизирует нуклеиновые кислоты для молекулярных амплификационных анализов.







