Оценка способности двух систем для транспортировки в жидкой среде к поддержанию жизнеспособности бактерий со сложными питательными потребностями

C. Biggs; The Chester County Hospital, West Chester, PA
КРАТКИЙ ОБЗОР:
Микробиологические методы работы претерпевают значительные изменения, что создает спрос на системы транспортировки с тампонами, дающие возможность решать и иные задачи помимо обычного посева культур. Мы сравнили две новые системы для транспортировки в жидкой среде: флок-тампон ESwab (ES; Copan, Murrieta, California) и пенополиуретановый аппликатор Sigma (SS; Medical Wire & Equipment) по их способности поддерживать жизнеспособность ряда важнейших аэробов и анаэробов, перед тем как выбрать систему для широкомасштабного применения . Жизнеспособность оценивалась с помощью модифицированного метода прокатывания тампоном (CLSI M40-A) с использованием тампонов, хранившихся при комнатной температуре (RT – room temperature, 20-25°C) и в холодильнике (RF – refrigerated temperature) в течение 0, 24 и 48 ч. Среди тестовых штаммов микроорганизмов были бактерии N. gonorrhoeae (NG) ATCC 43069, H. influenzae (HI) ATCC 10211, S. pyogenes (SP) ATCC 19615 и P. anaerobius (PA) ATCC 27337, P. melaninogenica (PM) ATCC 25845. Тампоны из каждой системы были засеяны аликвотой объёмом 100 мкл, приготовленной из суспензии каждого микроорганизма оптической плотностью 0,5 МкФ и рассчитанной на образование 30-300 КоЕ на чашку в начальный момент времени. Тампоны каждой системы засевались в трёх повторностях. Для каждого разведения и срока хранения был проведён расчёт количества колоний для сравнения с начальным моментом времени для определения коэффициента жизнеспособности. Система ES поддерживала жизнеспособность 4 из 5 штаммов после 24 ч хранения при комнатной температуре и всех 5 штаммов при хранении в холодильнике с более высоким коэффициентом жизнеспособности, чем у системы SS, во всех случаях. После 24 ч хранения при комнатной температуре коэффициент жизнеспособности для NG составлял 14% при использовании системы ES, 0% при использовании системы SS; HI 56% ES, 10% SS; SP 100% ES, 36% SS; PA 60% ES, 28% SS. При хранении в холодильнике коэффициент жизнеспособности NG составлял 29% при использовании системы ES, 9% SS; HI 92% ES, 75% SS; SP 82% ES, 53% SS; PA 81% ES, 51% SS; PM 67% ES, 0% SS. Определение жизнеспособности после 48 ч хранения для NG не проводилось, но из остальных микроорганизмов жизнеспособность при использовании системы ES сохранялась у 3 из 4 штаммов при комнатной температуре и у всех 4 штаммов при хранении в холодильнике, в то время при использовании системы SS у 1 из 4 штаммов и у 2 из 4 штаммов, соответственно. Система ES позволяет поддерживать жизнеспособность некоторых аэробов и анаэробов не менее 24 ч при хранении в холодильнике и демонстрирует более высокий коэффициент жизнеспособности в сравнении с системой SS. Флок-тампон системы ES обеспечивал более надёжную абсорбцию и транспорт микроорганизмов, чем пенополиуретановый аппликатор системы SS. Аппликатор системы SS нередко повреждал агар и периодически выпадал из крышки на чашку с агаром.
ВВЕДЕНИЕ
Транспортная среда Эймса и жидкая среда Стюарта с волокнистыми тампонами десятилетиями использовались в повседневной практике клинической микробиологии. Изменения в методах исследования образцов и проблемы, связанные с организацией рабочего процесса в микробиологии вызвали к жизни спрос на новый тип тампона, с помощью которого можно проводить сразу несколько тестов на одном образце и автоматизировать обработку образцов. Волокнистые тампоны суживают возможности тестирования и исключают его автоматизацию, и на рынке появилось новое поколение тампонов для транспортировки, удовлетворяющих обоим требованиям. Мы рассмотрели две системы для транспортировки, в которых весь образец разводится в жидкой фазе, образуя гомогенную суспензию: транспортная система Copan ESwab, содержащая 1 мл жидкой среды Эймса и укомплектованная патентованным флок-тампоном (Copan Diagnostics, Murrieta, CA), и транспортная система Medical Wire Sigma Swab, содержащая 1 мл жидкой среды Эймса и пенополиуретановый апппликатор (MW&E, Corsham, UK). Мы сравнили способность обеих транспортных систем поддерживать жизнеспособность определённых аэробов и анаэробов при комнатной температуре и при хранении в холодильнике в течение 24 и 48 ч.
МЕТОДЫ
Наша методика тестирования основывалась на методе прокатывания тампоном (стандарт CLSI M40-A). Согласно протоколу CLSI, были сделаны последовательные десятикратные разведения суспензий тестовых микроорганизмов для получения разведения, из которого при посеве на чашку Петри с каждого тампона в начальный момент времени вырастет количество колоний, которое можно подсчитать. Целью было засеять тампоны таким количеством колониеобразующих единиц, изменение которого которое можно визуально и количественно оценить в ходе хранения образца. Проведя в прошлом большое количество исследований транспортных тампонов, мы пришли к выводу, что применять общие правила расчета количества колониеобразующих единиц на основе оптической плотности по МакФарланду к микроорганизмам с разными колониеобразующими характеристиками и размерами клетки, ожидая при этом всегда получать 300 КоЕ на чашку, весьма затруднительно. Часто количество КоЕ получается слишком большим или слишком маленьким. Исходя из этого, мы разработали систему однократных разведений из исходной суспензии МакФарланда, которая позволяет получить число КоЕ, которые легко можно подсчитать невооружённым глазом. Это также сокращает количество рабочих операций, погрешности в разведении, воздействие кислорода и общее время работы с образцами.
Все тестовые штаммы были получены из новых лиофилизированных культур бактерий, взятых из ATCC (American Type Culture Collection – американская коллекция типовых культур), согласно инструкциям, полученным от поставщика. Все культуры посеяны одновременно с использованием подходящей неселективной среды и затем послужили источником для приготовления суспензии оптической плотностью 0,5 МкФ.
ОДНОКРАТНЫЕ РАЗВЕДЕНИЯ
Суспензии для засева тампонов приготовлены из исходной суспензии плотностью 0,5 МкФ посредством следующих разведений:
|
Штамм |
ATCC |
Однократное разведение суспензии оптической плотностью 0,5 МкФ* |
|
Streptococcus pyogenes (SP) |
19615 |
1:2000 |
|
Haemophilus influenza (HI) |
10211 |
1:10000 |
|
Neisseria gonorrhoeae (NG) |
43069 |
1:4000 |
|
Prevotella melaninogenica (PM) |
25845 |
1:1000 |
|
Peptostreptococcus anaerobius (PA) |
27337 |
1:500 |
*для засева каждого тампона было использовано 100 мкл разведения
Чтобы ускорить процесс засева множества тампонов, из каждой суспензии тестовых микроорганизмов аликвоты по 100 мкл с помощью пипетки перенесли в стерильные лунки микротитровального планшета. Каждый тампон помещали в лунку до соприкосновения с дном, после чего выдерживали как минимум 10 секунд для абсорбции инокулята (см. Рис. 1). Чтобы улучшить абсорбцию суспензии микроорганизмов, тампоны вращали. После засева тампоны удаляли из лунки, после чего переносили в соответствующие пробирки с транспортной средой согласно инструкции производителя. Посев с тампонов и тестирование проводили в трех повторностях для каждого микроорганизма и каждой точки времени (см. сводную таблицу ниже):
|
Тестовые микроорганизмы |
Температура хранения |
Начальный момент времени |
24 ч |
48 ч |
|
SP, HI, PM и PA |
20 - 25°C (RT) |
3 тампона |
3 тампона |
3 тампона |
|
|
4 - 8°C (RF) |
|
3 тампона |
3 тампона |
|
|
|
|
|
|
|
NG |
20 - 25°C (RT) |
3 тампона |
3 тампона |
|
|
|
4 - 8°C (RF) |
|
3 тампона |
|
ПОСЕВ С ПОМОЩЬЮ ТАМПОНОВ:
1. Перед посевом в начальный момент времени поместите тампон в пробирку для транспортировки на 5-15 минут.
2. Энергично встряхивайте пробирку с тампоном в течение 10-15 секунд.
3. Извлеките тампон из системы для транспортировки и произведите посев на соответствующую среду для культивирования штрихом по всей поверхности агара, поворачивая тампон между большим и указательным пальцами для равномерного контакта всей поверхности тампона с поверхностью культуральной среды. Дважды повторите посев штрихом, каждый раз поворачивая чашку Петри примерно на 60° для распределения инокулята, как указано в документе NCCLS M2 – Стандарты выполнения тестов на антимикробную чувствительность на чашках Петри. Избегайте касания края агара, чтобы получить пригодное для подсчета число КоЕ (Рис. 2).
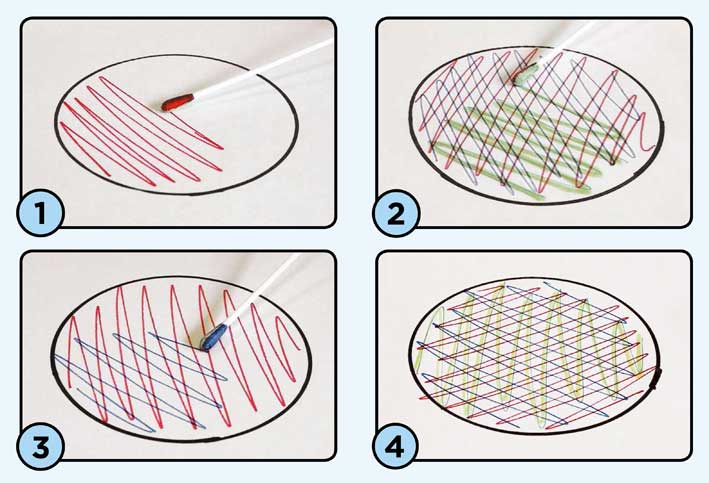
РЕЗУЛЬТАТЫ:
После 24 ч инкубации чашек Петри (48 ч для анаэробов) было подсчитано количество колоний, выросших при посеве с каждого тампона в каждый момент времени. Среднее число колоний подсчитывалось для каждой из трех повторностей и каждой длительности хранения образцов. Характеристики транспортных систем сравнивали путём подсчета количества КоЕ на чашках Петри, засеянных в начальный момент и в последующие моменты времени. Снижение жизнеспособности каждого организма выражалось в процентах от жизнеспособности в начальный момент времени. Согласно критериям CLSI M40-A, жизнеспособным микроорганизм признаётся в том случае, если среднее количество КоЕ по истечению указанного периода времени составляет > 5 КоЕ.
|
Микроорганизм |
Продукт |
Хранение |
Начальный момент времени |
Среднее количество КоЕ в начальный момент времени |
24 ч |
48 ч |
|
Streptococcus pyogenes |
Sigma |
RT |
100% |
180 |
36% |
37% |
|
|
ESwab |
RT |
100% |
325 |
100% |
100% |
|
|
Sigma |
RF |
100% |
180 |
53% |
57% |
|
|
ESwab |
RF |
100% |
325 |
82% |
66% |
|
Haemophilus influenzae |
Sigma |
RT |
100% |
40 |
10% |
0% |
|
|
ESwab |
RT |
100% |
145 |
56% |
16% |
|
|
Sigma |
RF |
100% |
40 |
75% |
60% |
|
|
ESwab |
RF |
100% |
145 |
92% |
60% |
|
Neisseria gonorrhoeae |
Sigma |
RT |
100% |
66 |
0% |
|
|
|
ESwab |
RT |
100% |
149 |
14% |
|
|
|
Sigma |
RF |
100% |
88 |
9% |
|
|
|
ESwab |
RF |
100% |
149 |
29% |
|
|
Prevotella melaninogenica |
Sigma |
RT |
100% |
20 |
0% |
0% |
|
|
ESwab |
RT |
100% |
102 |
0% |
0% |
|
|
Sigma |
RF |
100% |
82 |
3% |
0% |
|
|
ESwab |
RF |
100% |
102 |
67% |
24% |
|
Peptostrep. anaerobius |
Sigma |
RT |
100% |
107 |
28% |
0% |
|
|
ESwab |
RT |
100% |
442 |
60% |
12% |
|
|
Sigma |
RF |
100% |
107 |
51% |
26% |
|
|
ESwab |
RF |
100% |
442 |
81% |
76% |
При использовании транспортной системы ESwab коэффициент жизнеспособности бактерий во все моменты времени был существенно выше по сравнению с системой Sigma Swab. Система ESwab обеспечила поддержание жизнеспособности 5 из 5 бактерий при хранении в холодильнике в соответствии с критериями CLSI M40-A, в то время как система Sigma Swab обеспечила поддержание жизнеспособности лишь 4 бактерий. При комнатной температуре система ESwab обеспечила поддержание жизнеспособности 4 из 5 бактерий, а система Sigma Swab – только 1 из 5 бактерий.
Некоторые наблюдения, сделанные в ходе этого сравнительного исследования:
При попытке засеять пенополиуретановый аппликатор (система Sigma Swab) выяснилось, что он гидрофобен и, хотя его вращали и сжимали, он плохо абсорбировал суспензию микроорганизмов. В отличие от него, флок-тампон системы ESwab быстро абсорбировал суспензию микроорганизмов объёмом 100 мкл (Рис. 3).
1. Мы заметили, что количество КоЕ в начальный момент времени при использовании системы Sigma Swab было значительно ниже, чем при использовании системы Copan ESwab, что может отражать плохую абсорбционную способность аппликатора Sigma Swab.
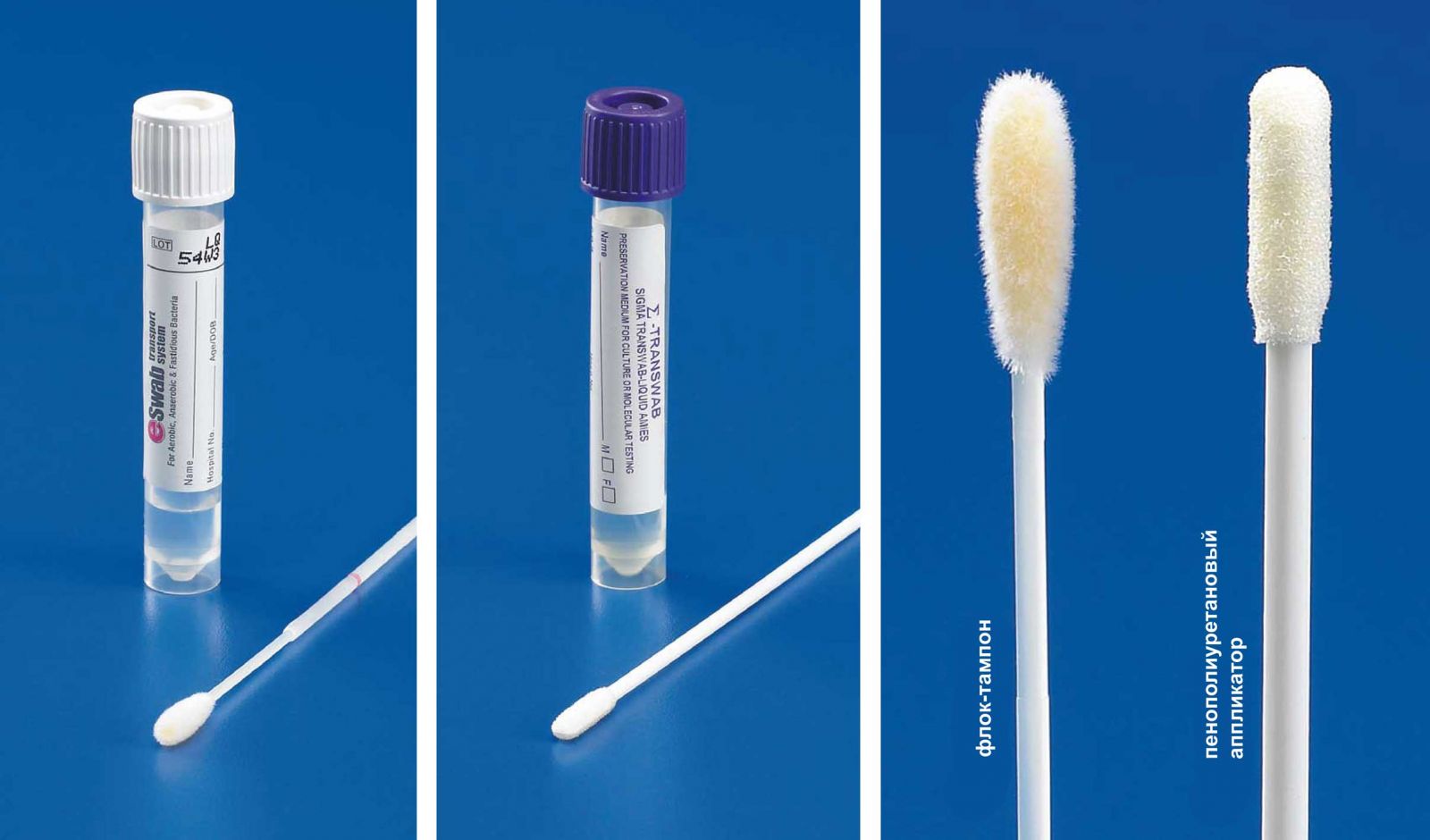
2. Пенополиуретановый аппликатор при посеве часто повреждал агар. Этому может способствовать шов на кончике тампона.
3. Транспортные пробирки Copan и MW&E имеют крышечку, предназначенную для захвата стержня тампона. Это позволяет при рассеве на чашки использовать крышечку как рукоятку. Пенополиуретановый апппликатор системы Sigma часто выпадал из крышечки.
ВЫВОДЫ
Транспортные системы, в которых образец разводится в среде для транспортировки – удобное решение, позволяющее проводить сразу несколько тестов на одном образце и автоматизировать обработку образцов. Наше исследование показало, что система Copan, в которой используется флок-тампон, является наиболее эффективной с механической точки зрения (абсорбция образца и его разведение) и с точки зрения способности поддерживать жизнеспособность бактерий.

* Для демонстрации присутствия бактериальной суспензии использован краситель







