Оценка WASP
20.12.2011
ЖУРНАЛ КЛИНИЧЕСКОЙ МИКРОБИОЛОГИИ, апрель 2009, стр. 1101–1106, Том 47, № 4
0095-1137/09/$08.00+0 doi:10.1128/JCM.01963-08
Copyright © 2009, Американское общество микробиологии. Все права защищены.
Первая оценка WASP, нового прибора автоматизированного микробиологического посева
Пол П. Бурбо и Бренди Линн Шварц
Медицинский центр Гейзингер, Дэнвилль, Пенсильвания
Получено 10 октября 2008/Возвращено для изменений 2 декабря 2008/
Утверждено 14 января 2009
Многие лаборатории испытывают все возрастающий дефицит в квалифицированном персонале в области микробиологии и лаборантах. Поэтому имеет место повышенный интерес к разработке нового автоматического прибора, который мог бы уменьшить потребность в рабочей силе для обработки образцов. В данном исследовании мы представляем впервые опубликованную оценку нового микробиологического инструмента, прибора автоматизированного микробиологического посева (WASP), произведенного компанией Копан, Инк., в которой мы исследовали такие показатели, как перекрестное заражение, точность посева и качество результатов. Отсутствие перекрестного заражения было подтверждено после посева 200 чередующихся пробирок с инокулированными и стерильными образцами. Возможность посева в приборе WASP в бульон для обогащения оценивали с использованием 106 образцов бульона Лим, и полученные результаты были сопоставимы с теми, которые были получены с использованием стандартных методов. Посев образцов мочи с использованием WASP сравнивался с посевом с помощью прибора Дайнакон Инокулаб. Триста образцов подвергались посеву в двух повторах с помощью обоих приборов с 1-мкл петлями и 293 образца – в двух повторах с помощью обоих приборов с 10-мкл петлями. Проводилось сравнение результатов тестирования в двух повторах одним и тем же прибором (посев в повторах) и соответствие обоих приборов. Результаты посева в повторах сравнивались для обоих приборов, при этом при посеве с помощью WASP больше образцов имели более выраженные результаты, чем при посеве только с помощью Инокулаб с 1-мкл петлей. И, наконец, посев 113 образцов в пробирках ЕСваб, ручным методом и с помощью WASP, обеспечил получение 90 потенциальных патогенов. В заключении мы сообщим результаты первой оценки нового прибора для микробиологического посева, WASP, предлагающего новые возможности для автоматического выполнения данной процедуры, которые ранее не были доступны.
В последние годы клинико-микробиологические лаборатории испытывают дефицит автоматических средств, доступных клиническим лабораториям, специализирующимся в других областях. В настоящее время широко используются системы посева крови с постоянным наблюдением, а также автоматические системы идентификации микроорганизмов и их чувствительности. Однако обработка образцов и результатов посевов, в частности, выполняются вручную, и за последние годы были внесены лишь незначительные изменения в используемые методы. Некоторые крупные лаборатории используют инструментарий для посева проб мочи, однако большинство микробиологических лабораторий не располагают автоматическим оборудованием на участках обработки проб. В данном отчете представлены результаты предварительной оценки нового прибора для микробиологического посева, который может в будущем автоматизировать процесс культивирования различных микроорганизмов с жидкой основой.
МАТЕРИАЛЫ И МЕТОДЫ
Обзор WASP. Прибор автоматизированного микробиологического посева (WASP) – новый инструмент, созданный итальянскими экспертами для компании Копан Диагностикс (Мурриета, Калифорния) и предназначенный для посева жидких образцов из различных средств транспортировки (Рис. 1 и 2). WASP включает в себя два селективных робота-сборщика Тошиба (СКАРА). Первый робот перемещает образцы и посевные среды и осуществляет забор образцов в устройство для открывания пробирок, второй робот осуществляет инокуляцию и посев штрихом по чашке. Считыватели штрих-кода WASP сканируют пробирку с образцом, а принтер распечатывает информацию и штрих-код на ярлыке, который прикрепляют к посевной среде. На вращающемся устройстве с девятью держателями крепятся 342 стандартных BD чашки (Бектон Дикинсон Микробиолоджи Системз, Кокейсвилль, Мэрилэнд) или 378 стандартных Ремел (Ленекса, Канзас) чашек. WASP может обрабатывать лишь транспортное оборудование с жидкими образцами. За исключением больших пробирок с мочой (120 мл пробирки в нашей лаборатории), все образцы загружают в WASP с помощью специальных тефлоновых поддонов с лунками, размеры которых соответствуют размерам контейнеров. Например, поддоны одного типа держат 12 пробирок Вакутейнер для транспортировки мочи, поддоны второго вида – 12 пробирок ЕСваб, а поддоны третьего вида – 6 пробирок с транспортной средой для энтеральных микроорганизмов. За один раз в прибор можно загружать до 6 поддонов, т.е. не более 72 пробирок Вакутейнер или ЕСваб пробирок за один раз. WASP также имеет вихревую мешалку и вращатель/центрифугу, которые используются для подготовки образцов к посеву. Сам посев осуществляется с помощью трех металлических петель, встроенных в трехгранный посевной инструмент (Рис. 3). Петли бывают трех размеров: 1 мкл, 10 мкл и 30 мкл. WASP имеет несколько датчиков для обеспечения правильного выполнения операции, в том числе один датчик, присоединенный к камере, контролирующей захват образца петлей после ее погружения в него. Сенсорный компьютер облегчает выбор протоколов посева, сред и вариантов штрихования образцов и другие функции, а также позволяет следить за работой WASP.
Описанная здесь оценка состояла из предварительного изучения первой серийной версии WASP в клинико-микробиологической лаборатории. В период проведения данной оценки WASP был оснащен оборудованием, позволяющим обрабатывать лишь образцы мочи в пробирках Вакутейнер, УриСваб и ЕСваб. Следовательно, данная оценка имела отношение лишь к указанным видам оборудования для транспортировки образцов.
Исследование перекрестного заражения. Для определения потенциального перекрестного заражения, когда образцы последовательно штрихуются в WASP, исследования проводились на пластиковых пробирках Вакутейнер Урин К&С Презерватив Плюс (БД) и пробирки ЕСваб (Копан). Свежая субкультура E. coli (ATCC 35218) использовалась для приготовления суспензии, эквивалентной стандарту 0.5 McFarland в стерильном физиологическом растворе. Осуществлялось разведение для получения суспензии микроорганизмов ~ 105 КОЕ/мл и ~ 106 КОЕ/мл.
4 мл стерильного раствора добавляют к каждой из 50 пробирок Вакутейнер, а 4 мл суспензии 105 КОЕ/мл E. coliдобавляют к каждой из дополнительных 50 пробирок Вакутейнер. Затем пробирки помещают в соответствующий поддон WASP, чередуя пробирки с суспензией E. coliи пробирки со стерильным раствором. Поддоны помещают в WASP, и для каждой из 100 пробирок Вакутейнер используется стандартный вариант штрихования образцов мочи с использованием чашки с кровяным агаром (BAP) и чашки с агаром МакКонки (MAC). Содержимое всех пробирок Вакутейнер подвергалось посеву сначала с использованием 1 мкл петли, а затем повторно с помощью 10 мкл петли. В результате было получено 200 наборов чашек: 100 наборов со стерильным физиологическим раствором и 100 наборов с суспензией E. coli. Чашки инкубировались при температуре 37°C, и спустя 24 часа проводился анализ посева.

Рис. 1. WASP, вид спереди. Размеры прибора – 75 дюймов в ширину,
75 дюймов в высоту и 43 дюйма в глубину.
Для анализа пробирок ЕСваб 0,1 мл 106-КОЕ/мл суспензии E. coliдобавляли к каждой пробирке ЕСваб (пробирки ЕСваб содержат 1 мл жидкой транспортной среды Амиеса). Пробирки помещали в соответствующий поддон WASP, чередуя пробирки с суспензией E. coliи пробирки только с транспортной средой. Поддоны помещали в прибор WASP и для каждой из 100 пробирок ЕСваб выбирали трехгранный вариант штрихования образцов с чашкой, содержащей кровяной агар и MакКонки агар. Содержимое всех пробирок ЕСваб обрабатывали сначала с помощью 1 мкл петли и повторно тестировали с помощью 30 мкл петли. В результате было получено 200 наборов чашек: 100 наборов инокулировали стерильным физиологическим раствором и 100 – суспензией E. coli. Чашки инкубировали при температуре 37°C, и спустя 24 часа проводился анализ посева.
Субкультуры бульонов для обогащения. Для подтверждения точности WASP в отношении субкультур бульонов для обогащения проводилось испытание с использованием бульонов Лим (Ремел). Для данного испытания использовались стандартные бульоны Лим, инокулированные пренатальными стрептококками группы В, полученными из микробиологической лаборатории медицинского центра Гейзингер. Вагинальные и ректальные мазки инкубировались в бульоне Лим в течение 18-24 часов, а затем подвергались последующему посеву для стандартного испытания.
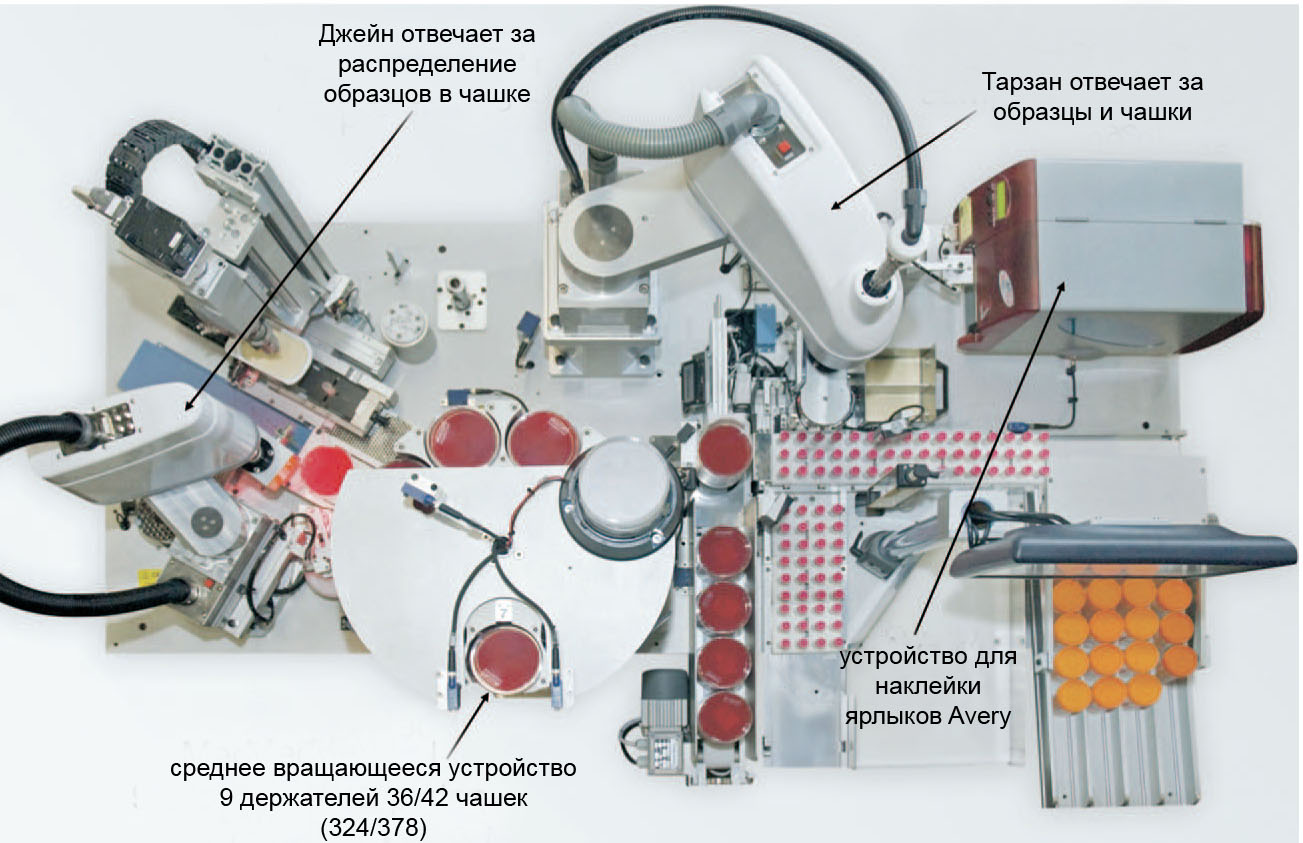
Рис. 2. WASP, вид сверху. Два SCARA робота условно обозначены Тарзан и Джейн.

Рис. 3. Трехгранные петли: слева направо, 10-мкл, 30-мкл и 1-мкл петли.
После завершения стандартного повторного тестирования пробирки с бульоном Лим встряхивали, затем 1 мл переносили из каждой пробирки с бульоном Лим в пустую стерильную ЕСваб пробирку. ЕСваб пробирки с бульоном Лим впоследствии подвергали повторному посеву в чашках с агаром из неомицин-налидиксовой кислоты (BD) и кровяного агара в WASP с помощью 10-мкл петли. Показатели посева считывали и обрабатывали через 24 и 48 часов, а полученные результаты сравнивали с данными, полученными при стандартном посеве.
Посев образцов мочи. Прибор Инокулаб (Дайнакон Инк., Миссиссауга, Онтарио, Канада) используется для стандартного посева образцов мочи, доставленных в пробирках Вакутейнер в микробиологическую лабораторию при медицинском центре Гейзингер. Чашки в Инокулаб инокулируются либо 1 мкл, либо 10 мкл петлями. Для данной валидации стандартные пробы мочи, полученные в BD пробирках Вакутейнер, сначала подвергались посеву в приборе Инокулаб в чашках с кровяным агаром и агаром МакКонки с помощью 1-мкл петли для стандартного микробиологического лабораторного посева, полученные культуры обрабатывают и регистрируют согласно стандартным протоколам микробиологической лаборатории Гейзингер. Все образцы затем подвергают повторному посеву в Инокулаб, а на чашки наклеивают специальные ярлыки. Те же образцы затем повторно засевают с помощью 1 мкл петли в WASP в чашках с кровяным агаром и агаром МакКонки в двух повторах и проводят идентификацию для исследования. В общей сложности проводится четыре посева (дважды в Инокулаб и дважды в WASP). Дополнительные образцы затем дважды культивируют в Инокулаб и WASP с помощью 10-мкл петель.
Все планшеты помещают в не-CO2 инкубатор, по меньшей мере, на 16 часов. Результаты одного набора чашек из Инокулаб, инокулированных с помощью 1-мкл петли, считывает и регистрирует лаборант микробиологической лаборатории Гейзингер, а остальные наборы чашек считывались кем-либо из нас (B.L.S.). Для обработки всех посевов использовались стандартные процедуры, применяемые в микробиологической лаборатории Гейзингер. Старший лаборант или один из нас (P.P.B.) просматривали все противоречивые результаты.
Пробирки ЕСваб. Стандартные культуры из различных источников, предоставленные в лабораторию в ЕСваб пробирках, подвергались посеву в WASP. После завершения стандартного ручного посева образцы загружали в WASP и инокулировали с помощью трехгранного варианта штрихования образцов с чашками, содержащими кровяной агар и МакКонки агар и шоколадный агар. 30 мкл петля WASP использовалась для инокуляции всех чашек.
Все культуры, засеянные в WASP, обрабатывались независимо от культур, засеянных вручную. После завершения проводилось сравнение результатов с таковыми, полученными при ручном посеве.
РЕЗУЛЬТАТЫ
Исследование перекрестного заражения. В общей сложности, 50 инокулированных и стерильных Вакутейнер пробирок поочередно загружали в WASP. Производился посев 200 культур с помощью 1-мкл и 10-мкл петель. В стерильных пробирках колонии отсутствовали, а в инокулированных пробирках отмечалась стойкая «штриховка». Аналогичные результаты были получены в пробирках ЕСваб с использованием 10-мкл и 30-мкл петель, в стерильных пробирках рост микроорганизмов отсутствовал, а в инокулированных пробирках была стойкая «штриховка».
Субкультуры бульонов для обогащения. В общей сложности, 106 образцов подвергались повторному посеву в бульоне Лим в WASP. Предварительные исследования (данные не приведены) показали, что использование 30-мкл петли не обеспечивало достаточное количество изолированных колоний. Однако использование 10-мкл петли обеспечивало стойкое количество выделенных колоний. При использовании 10-мкл петли имело место 100% соответствие результатов таковым, полученным при стандартном посеве; каждая петля давала 20 положительных и 86 отрицательных результатов.
Посев образцов мочи. 300 образцов прошли обработку в двух повторах в WASP и Инокулаб с использованием 1-мкл петли и 293 образца были обработаны в двух повторах в обоих приборах с помощью 10-мкл петель. Одни и те же образцы необязательно использовались для 1-мкл и 10-мкл петель, поэтому результаты были проанализированы. Это означает, что анализ результатов проводился отдельно, в зависимости от размера петли. Результаты посева подразделялись на потенциально значимые и потенциально незначительные.
Для образцов, культивированных с помощью 1-мкл петли, один или несколько изолятов с < 10,000 КОЕ/мл и культуры с тремя и более микроорганизмами каждый при <10,000 КОЕ/мл (многообразная микрофлора) считались незначительными, например, изоляты Micrococcusspp. и Lactobacillusspp. в любом количестве. С целью данного исследования, коагулаза-отрицательные стафилококки и стрептококки viridans считались значимыми, если присутствовали в концентрации ≥ 10,000 КОЕ/мл и в виде единичного патогена или не более чем с одним микроорганизмом. С целью табулирования данных, если культура содержала ≥10,000 КОЕ потенциального патогена (например, E.coli) и <10,000 КОЕ/мл одного или двух других микроорганизмов, изолят E.coli относили к значимым изолятам, а другой(ие) микроорганизм(ы) относили к незначимым изолятам. Для образцов, культивированных с помощью 10-мкл петель, интерпретация полученных результатов проводилась таким же образом, но с учетом 10-кратной разницы в факторе разведения. Результаты посева в Инокулаб и WASP оценивались двумя способами. Во-первых, результаты повторов сравнивали для каждого прибора. Например, результат, полученный для образца 1, культивированный в WASP с помощью 1-мкл петли, сравнивали с результатами второго посева образца 1 в WASP с помощью петли того же размера. Во-вторых, сравнивались значимые изоляты обоих приборов.
Таблица 1. Результаты посева в повторах для значимых изолятов
|
Прибор
|
1-мкл инокулят
|
10-мкл инокулят
|
||
|
Итогоɑ
|
Аналогичный результатb
(тот же диапазон КОЕ)
|
Итого
|
Аналогичный результат
(тот же диапазон КОЕ)
|
|
|
Инокулаб
|
80
|
80 (75)
|
71
|
71 (70)
|
|
WASP
|
81
|
80 (79)
|
70
|
70 (70)
|
ɑ Общее количество значимых изолятов для данного прибора.
bТот же результат, количество микроорганизмов, одинаковых в повторных посевах с показателями ≥104 КОЕ/мл для 1-мкл инокулята и ≥103 КОЕ/мл для 10-мкл инокулята.
сТот же диапазон КОЕ, количество микроорганизмов (указано в скобках) с аналогичными результатами в обоих повторах (103-104 КОЕ/мл, 104-105 КОЕ/мл или >105 КОЕ/мл).
Результаты повторов для образцов со значимыми изолятами приведены в Таблице 1. Оба прибора давали схожие результаты при посеве в повторах в отношении значимых изолятов при использовании петель обоих размеров. При подсчете (тот же диапазон КОЕ/мл, например, оба повтора > 105 КОЕ/мл) значимых различий между результатами обоих приборов не отмечалось.
Для культур с незначимыми результатами имело место соответствие для Инокулаб между парными чашками при использовании 1-мкл петли для 184/223 результатов и 10-мкл петли для 219/220 результатов. При использовании WASP в отношении образцов с незначимыми результатами имело место соответствие при использовании 1-мкл петли для 192/220 результатов и 10-мкл петли для 218/220 результатов. Большинство противоречивых результатов было получено в образцах с отсутствием роста на одном наборе чашек и <10 фактических колоний на парных чашках для посева.
Результаты, полученные в WASP и Инокулаб для образцов со значимыми результатами, не имеющие соответствия, представлены в Таблице 2. Из 74 образцов со значимыми результатами, культивированными 1-мкл петлей, 11 образцов дали противоречивые результаты. Из 5 образцов один результат, полученный в Инокулаб, не соответствовал трем остальным результатам, а еще один результат, полученный в WASP, противоречил трем остальным результатам. Было выделено лишь четыре значимых изолята в двух посевах в WASP. И, наконец, для одного образца имело место различие в числе КОЕ/мл между двумя посевами в WASP и двумя в Инокулаб.
Из 65 образцов со значимыми результатами, культивированных с помощью 10-мкл петли, 7 образцов дали противоречивые результаты. Результат для одного из образцов, полученных в WASP и Инокулаб, не соответствовал трем другим результатам. Из 5 образцов имело место различие в количестве КОЕ/мл между двумя посевами WASP и двумя посевами Инокулаб.
Посевы ЕСваб. В общей сложности 113 образцов было собрано в пробирки ЕСваб, которые были культивированы в WASP. Данные образцы включали 13 вагинальных мазков и 100 образцов для стандартного посева смешанных типов (рана, дренаж, жидкость, смыв из ноздрей, с кожи, мазки из верхних дыхательных путей и другие образцы).
Таблица 2. Результаты, полученные в WASP и Инокулаб в отношении образцов,
давших значимые результаты, не соответствующие остальным результатама
|
Размер петли
|
Микроорганизмы, определяемые с помощью:
|
|||
|
Инокулаб
|
WASP
|
|||
|
Повтор 1
|
Повтор 2
|
Повтор 1
|
Повтор 2
|
|
|
1 мкл
|
Множественная микрофлора
|
< 104 смешанная микрофлора
|
104-105 Enterococcus,
< 104 два других микроорганизма
|
104-105 Enterococcus,
< 104 два других микроорганизма
|
|
< 104 смешанная микрофлора
|
< 104 смешанная микрофлора
|
104-105 бета-гемолитические стрептококки
|
104-105 бета-гемолитические стрептококки
|
|
|
< 104 одного типа
|
< 104 одного типа
|
104-105 Enterococcus
|
104-105 Enterococcus
|
|
|
< 104 одного типа
|
Рост отсутствует
|
104-105
K.Pneumoniae, < 104 одного типа
|
104-105
K.Pneumoniae, < 104 одного типа
|
|
|
> 105 E. coli
|
104-105 E. coli
|
> 105 E. coli
|
> 105 E. coli
|
|
|
> 105 E. coli
|
104-105 E. coli
|
> 105 E. coli
|
> 105 E. coli
|
|
|
> 105 бета-гемолитические стрептококки
|
104-105 бета-гемолитические стрептококки
|
> 105 бета-гемолитические стрептококки
|
> 105 бета-гемолитические стрептококки
|
|
|
104-105 S. aureus
|
104-105 S. aureus
|
> 105 S. aureus
|
104-105 S. aureus
|
|
|
104-105 Proteus mirabilis
|
104-105 P. mirabilis
|
>105 P. mirabilis
|
>105 P. mirabilis
|
|
|
104-105 NLF
|
>105 NLF
|
>105 NLF
|
>105 NLF
|
|
|
104-105 CoNS
|
>105 CoNS
|
>105 CoNS
|
>105 CoNS
|
|
|
<104 один ОТ
|
<104 один ОТ
|
<104 один ОТ
|
<104 один ОТ
|
|
|
10 мкл
|
Множественная микрофлора
|
Множественная микрофлора
|
103-104 CoNS,
<103 один ОТ
|
Множественная микрофлора
|
|
< 103 два организма
|
< 103 два организма
|
103-104 Enterococcus,
<103 один ОТ
|
103-104 Enterococcus,
<103 один ОТ
|
|
|
< 102 смешанная микрофлора
|
103-104 CoNS,
<102 один ОТ
|
103-104 CoNS,
<103 один ОТ
|
103-104 CoNS,
<103 один ОТ
|
|
|
103-104E. coli
|
103-104E. coli
|
> 104E. coli
|
> 104E. coli
|
|
|
103-104 GBS
|
103-104 GBS
|
>104 GBS
|
>104 GBS
|
|
|
103-104 Enterococcus
|
103-104 Enterococcus
|
>104
Enterococcus
|
>104
Enterococcus
|
|
|
103-104 стрептококки viridans
|
103-104 стрептококки viridans
|
>104
стрептококки viridans
|
>104
стрептококки viridans
|
|
|
<102 один ОТ
|
<102 один ОТ
|
<102 два ОТ
|
<102 один ОТ
|
|
а ОТ, другого типа; GBS, стрептококки группы В; CoNS, коагулаза-отрицательные стафилококки; NLF, не идентифицированные, не ферментирующие лактозу грамотрицательные бактерии.
Все чашки инокулировались 30-мкл петлей, а результаты считывались спустя 24 и 48 часов после инкубации. Посев вручную и в WASP показал наличие 90 потенциальных патогенов. Обнаружение нормальной микрофлоры (кожной, вагинальной и респираторной) также было одинаковым при посеве вручную и в WASP. В одном из посевов WASP выросла одна колония плесеней, которая не обнаруживалась вручную.
ОБСУЖДЕНИЕ
Многие лаборатории испытывают все возрастающий дефицит квалифицированного в области микробиологии персонала и лаборантов. Данная ситуация усугубляется не только увеличением скорости стандартного анализа, но и спросом на испытания, проводимые с эпидемиологической целью, например, в отношении метициллин-резистентного Staphylococcusaureus(3). Следовательно, имеет место повышенный интерес к автоматизации данного процесса, который позволит снизить спрос на рабочую силу для обработки образцов (7).
Существующие приборы микробиологической обработки включают аппараты для посева штрихом и посевные приборы. В настоящее время имеется три прибора для инокуляции и штрихования образцов: Дайнакон Инокулаб (модели LQ и LQH), биоМерье МикроСтрик и WASP.
Приборы Инокулаб предназначены для посева образцов мочи из одного типа контейнеров. Тип контейнера выбирается в момент покупки прибора. Дайнакон модель LQH, имеющийся в нашей лаборатории, вмещает в себя 38 неинокулированных чашек Ремел, т.е. возможен анализ либо 19 образцов без повторной загрузки при использовании двух чашек для каждого посева, либо 38 образцов без повторной загрузки при использовании одной чашки для каждого посева. Поскольку модель LQH имеет лишь один держатель для неинокулированных чашек, при использовании более одного вида чашек для посева необходимо добавить чашки. Приборы Инокулаб также могут использоваться только с целью штрихования.
Прибор МикроСтрик был выпущен в 2008 году (2). При его использовании для каждого образца требуется закупоренный одноразовый наконечник для пипетки, а для каждой чашки – один одноразовый пластмассовый аппликатор. Возможен посев в чашках одного либо двух видов, а аппликатор распределяет инокулят по всей площади стандартной 100-мм чашки или двойной чашки. Самая маленькая пипетка, подходящая для МикроСтрик, по размеру составляет 10 мкл, и необходимо удалить крышку с образца в тот момент, когда образец помещают в прибор. Если оставшуюся часть образца необходимо сохранить, нужно снова накрыть его после инокуляции в чашке (2).
Данное исследование представляет собой предварительную оценку нового прибора WASP. Данная оценка ограничивалась двумя типами контейнеров: пробирки Вакутейнер и ЕСваб. Оборудование, появившееся уже после проведения данного исследования, позволяет проводить испытания с использованием других типов контейнеров с образцами. Мы провели сравнение инокуляции образцов мочи в пробирках Вакутейнер с помощью WASP и Инокулаб LQH. В ходе данного исследования посев вручную не проводился, поскольку, согласно нашим внутренним стандартам валидации Инокулаб, результаты, полученные с использованием данного прибора, отличались большей воспроизводимостью, чем результаты, полученные при посеве вручную. Лью и др. также показали в лабораторных условиях, что прибор Инокулаб отличается большей точностью, чем посев вручную с помощью 1-мкл петли (5). Кроме того, имела место вариабельность объема образцов мочи, переносимых вручную (1). Мы также провели оценку точности результатов WASP в сравнении с субкультурами в бульонах Лим. И, наконец, было проведено сравнение ручного посева стандартных образцов, собранных в ЕСваб пробирки, с посевом, проведенным в WASP.
Результаты, полученные с помощью Инокулаб и WASP в отношении посева образцов мочи, были сопоставимы для образцов, культивированных с помощью 1-мкл и 10-мкл петель. Любопытен тот факт, что в четырех образцах, посеянных 1-мкл петлей, выросло большое количество патогена в концентрации 104-105 КОЕ/мл в обеих культурах WASP (два – Enterococcusspp. и по одному – Klebsiellapneumoniaeи бета-гемолитический стрептококк), а посев Инокулаб показывал наличие смешанной или множественной микрофлоры. Аналогичным образом, в одном образце, культивированном 10-мкл петлей, вырос Enterococcussp. в концентрации 103-104 КОЕ/мл в обеих культурах WASP и смешанная микрофлора – в образце, культивированном в Инокулаб.
Существует несколько возможных объяснений различий в результатах в образцах WASP и Инокулаб: (i) случайные различия в числе КОЕ вблизи контрольных точек относительно данных микроорганизмов, (ii) неудачный захват образца петлей (потеря мениска) и (iii) более однородное приготовление образца в одном приборе по сравнению с другим. Различия между функционированием Инокулаб и WASP говорят в пользу последних двух вариантов. В WASP встроена камера, определяющая наличие капель внутри инокулирующей петли после забора образца. Если образец не обнаруживается, петля возвращается в пробирку повторно; при необходимости, так же поступают в третий раз. Если камера не может снова определить каплю, пробирку выбрасывают. Инокулаб не имеет датчика для определения захвата образца петлей. Второе различие между приборами состоит в приготовлении образца перед его забором. Согласно руководству пользования Инокулаб, образец необходимо взболтать, прежде чем поместить в прибор, однако в нем не указано, как именно нужно взбалтывать образец. WASP же имеет вихревую мешалку, которая энергично встряхивает пробирку с мочой до ее забора. Точная причина наблюдаемых различий до конца не ясна; тем не менее, возможность подтвердить фактическое наличие образца в петле для инокуляции, а также энергичное встряхивание до посева образца теоретически являются преимуществами использования WASP в сравнении с Инокулаб.
Разумеется, необходимо проведение исследований по оценке скорости, производительности и сокращения трудоемкости WASP. В период проведения данного предварительного изучения требовалось 27 минут на посев образцов в WASP из 24 пробирок Вакутейнер в две чашки каждый, тогда как в случае применения Инокулаб требовалось 24 минуты для посева образцов из 24 пробирок Вакутейнер в две чашки. Мы ожидаем получения дополнительных данных после полной валидации и обновления программного обеспечения Санкуэст Лаборатори Информейшн Систем.
Также имеются значимые различия в производительности между Инокулаб и WASP. Дайнакон Инокулаб модель LQH, используемый в нашей лаборатории, держит 38 неинокулированных чашек Ремел, тогда как WASP – 378 чашек Ремел. Поскольку в Дайнакон Инокулаб модель LQH встроен лишь один держатель для неинокулированных чашек, при использовании более одного вида чашек для посева требуются дополнительные чашки. При использовании одной чашки этого не требуется. Дайнакон Инокулаб модель LQ имеет два держателя для инокулированных сред, что позволяет использовать по одному держателю для каждого из двух видов сред для каждого образца. WASP имеет девять держателей, на каждом крепится 42 чашки Ремел, поэтому в один заход можно загружать девять видов сред. Один и тот же вид сред можно загружать на несколько держателей. Например, если в лаборатории используется кровяной агар для большинства видов образцов, можно, например, загрузить три держателя с кровяным агаром и меньше держателей другими видами сред.
В ходе проведенной нами оценки WASP не возникало проблем с субкультурами бульонов на засеваемых средах. С помощью 10-мкл петли WASP стабильно продуцировал изолированные колонии. Для данного исследования бульоны Лим переносились в пустые пробирки ЕСваб. На наш взгляд, вряд ли лаборатории сделают его использование стандартной практикой. Вариантом решения данной проблемы может стать обработка бульонов в пробирках меньшего размера компанией Копан и/или другим производителем или изменение программного обеспечения WASP для возможности анализа более высоких пробирок.
Хотя наша оценка WASP для посева стандартных культур ограничивалась 113 образцами, полученные результаты были сопоставимы с таковыми при ручном посеве. Мы разработали трехгранный вариант штрихования при помощи 30-мкл петли, который применялся ко всем образцам. WASP обладает возможностью обрабатывать контейнеры разных размеров. «Челюсти» робота имеют три варианта настройки для захвата контейнеров трех размеров. Имеются три стыковочных станции (стыковочная станция держит дно контейнера во время снятия колпачка), которые также размещают в себе контейнеры трех размеров. Стыковочную станцию можно выгрузить из прибора. WASP имеет два приспособления для удаления колпачков. Один плотно зафиксирован и предназначен для пробирок с мочой Вакутейнер. Другие варианты приспособлений для удаления колпачков можно установить во вторую станцию удаления колпачков, в том числе приспособление для удаления колпачков с пробирок ЕСваб. С целью данного исследования мы использовали устройство для удаления колпачков и стыковочную станцию, предназначенные для пробирок ЕСваб. В период данной оценки мы не сталкивались с проблемами открывания и закрывания пробирок Вакутейнер либо ЕСваб. Далее устанавливался интерфейс между WASP и системой Санкуэст Лаборатори Информейшн Систем. Несмотря на пригодность к функционированию, она еще подлежит полной валидации. В отличие от МикроСтрик и подобно Инокулаб, WASP не требует одноразовых материалов для посева. Возможность посева с помощью 1- либо 10-мкл петли позволяет лабораториям гибко подходить к достижению различных клинических задач (4, 6).
Единственной механической проблемой, с которой мы столкнулись во время исследования, был сгоревший сжигатель, который был заменен. Отмечалось несколько проблем, которые систематически устранялись компанией Копан по мере появления. Все проблемы были устранены.
Данное исследование представляет собой предварительную оценку нового прибора WASP. По мере расширения его использования на других видах образцов мы стараемся оптимизировать производительность для каждого вида образцов. При стандартном использовании пробирок ЕСваб производился посев вручную с помощью одноразовой пипетки емкостью около 28 мкл/капля. Каждый фрагмент среды получает 1 каплю инокулята, а при анализе образцов, требующих окрашивания по Граму, каплю помещают на предметное стекло. Предположительно, аналогичный процесс имеет место при использовании WASP, с приготовлением всех необходимых предметных стекол перед загрузкой контейнеров в WASP для посева. Важно понимать, что единственный вид тампонов, который можно культивировать в WASP - это тот, на котором образец переносится в жидкую фазу. ЕСваб – в настоящее время единственный подходящий для этого вид. ЕСваб дороже стандартных тампонов для обработки ран, и в лабораториях, не использующих ЕСваб, такое увеличение затрат должно быть включено в производственный бюджет WASP.
Вероятнее всего, относительное число образцов, которые может культивировать лаборатория с помощью WASP, будет в значительной степени зависеть от объема образцов для определенного анализа и среды, необходимой для определенного образца и анализа. Например, если каждый день лаборатория осуществляет посев в среднем пяти образцов определенного вида, и для данного анализа требуется среда, не используемая при выполнении других анализов, удаление среды с держателей и добавление требуемой среды в держатели может быть нерациональным. Следует учитывать, что существующий метод работы WASP предназначен для тестирования партий, а не для испытания случайных партий.
Здесь представлен отчет о первой оценке нового прибора для обработки микробиологических образцов WASP. Производительность прибора весьма многообещающа и обладает возможностями по автоматизации процесса анализа микробиологических образцов, которая до настоящего времени была невозможна. Необходимо проведение дополнительных исследований в этой и других лабораториях для полного изучения возможностей данного прибора.
БЛАГОДАРНОСТИ
Данное исследование проводилось при поддержке Копан, Инк.







